Класс под названием гликопротеины или, более корректно, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе.
Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между этими подклассами имеются существенные отличия:
Гликопротеины |
Протеогликаны |
|
|
Гликопротеины
Для собственно гликопротеинов характерно низкое содержание углеводов. Углеводный остаток является олигосахаридом, имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, и их аминопроизводные, также N-ацетилнейраминовую кислоту. Олигосахарид присоединен к аминокислотам белковой цепи либо N-гликозидной связью - к амидному азоту аспарагина, либо О-гликозидной связью - к гидроксигруппе остатков серина, треонина, гидроксилизина.

Способы присоединения углевода к белку
Функцией гликопротеинов являются:
1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин.
2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген).

Схема строения белка-рецептора
3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ.
4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны.
5. Ферментативная – холинэстераза, нуклеаза.
6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.
Протеогликаны
Другая группа гликоконъюгатов – протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков.
Дисахариды включают в себя какую-либо уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. Для углеводной части встречаются другие названия – кислые гетерополисахариды (т.к. имеют много кислотных групп), гликозаминогликаны (содержат аминогруппы). Избыток анионных групп (сульфатных, карбоксильных) придает молекулам гликозаминогликанов высокий отрицательный заряд.
Основными представителями структурных гликозаминогликанов являются гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты. Эти молекулы входят в состав протеогликанов, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур.

Строение гиалуроновой кислоты и хондроитинсульфата
Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
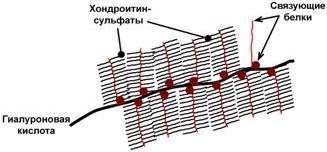
Схема строения протеогликанов
межклеточного вещества
По функции структурные протеогликаны значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. При помощи электронной микроскопии выяснено, что они имеют древовидную структуру. Молекулы гликанов весьма гидрофильны, создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов.
Еще одним представителем протеогликанов является гепарин, включающий несколько сульфатированных цепей гетерополисахарида, связанного с белковым ядром через остатки серина. В крови гепарин связывается с антитромбином III, образуя комплекс, блокирующий факторы свертывания крови IIа, IХа, Ха, XIa и ХIIа, что применяется для профилактики тромбозов у больных различного профиля. В настоящее время используются препараты низкомолекулярных гепаринов и нефракционированных гепаринов, обладающие лучшими характеристиками.
Также функцией гепарина является активирующее влияние на активность фермента липопротеинлипазы, участвующего в метаболизме транспортных форм липидов в крови (хиломикроны и липопротеины очень низкой плотности). Как следствие, количество липидов в крови снижается.
3. Ферментативный аппарат репликации прокариот. Бактериальные ДНК-зависимые ДНК-полимеразы, субъединичный состав и активности; вспомогательные ферменты и белки. Точность матричного синтеза полинуклеотидов. Ковалентные модификации ДНК
Ферменты (хеликаза, топоизомераза) и ДНК-связывающие белки расплетают ДНК, удерживают матрицу в разведённом состоянии и вращают молекулу ДНК. Правильность репликации обеспечивается точным соответствием комплементарных пар оснований и активностью ДНК-полимеразы, способной распознать и исправить ошибку. Репликация у прокариот осуществляется несколькими разными ДНК-полимеразами. ДНК-полимераза I действует на запаздывающей цепи для удаления РНК-праймеров и дорепликации очищенных мест ДНК. ДНК полимераза III — основной фермент репликации ДНК, осуществляющий синтез ведущей цепи ДНК и фрагментов Оказаки при синтезе запаздывающей цепи. Далее происходит закручивание синтезированных молекул по принципу суперспирализации и дальнейшей компактизации ДНК. Синтез энергозатратный. Цепи молекулы ДНК расходятся, образуют репликационную вилку, и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две новые двуспиральные молекулы ДНК, идентичные родительской молекуле. ДНК-полимераза — фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона. Тип нового нуклеотида определяется по принципу комплементарности с шаблоном, с которого ведётся считывание. Собираемая молекула комплементарна шаблонной моноспирали и идентична второму компоненту двойной спирали. Выделяют ДНК-зависимую ДНК-полимеразу (КФ 2.7.7.7), использующую в качестве матрицы одну из цепей ДНК, и РНК-зависимую ДНК-полимеразу (другое название обратная транскриптаза, КФ 2.7.7.49), способную также к считыванию информации с РНК (обратная транскрипция). ДНК-полимеразу считают холоферментом, поскольку для нормального функционирования она требует присутствия ионов магния в качестве кофактора. В отсутствии ионов магния о ней можно говорить как об апоферментe.
ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком цепи нуклеотидов. Среднее количество нуклеотидов, присоединяемое ферментом ДНК-полимеразой за один акт связывания/диссоциации с матрицей, называют процессивностью.
Матричная природа синтеза нуклеиновых кислот и белков обеспечивает высокую точность воспроизведения информации. Так, в ходе репликации дочерние молекулы ДНК синтезируются на нитях материнской ДНК. При образовании всех видов РНК, необходимых для синтеза белков, информация об их структуре "считывается" с определённых генов в молекулах ДНК. В синтезе новых молекул белков матрицей, содержащей информацию об их строении, являются мРНК.
Физиологическое метилирование ДНК – единственная ковалентная модификация молекулы ДНК –осуществляется путем переноса метильной группы с S-аденозил метионина на 5-ю позицию пуринового кольца цитозина.


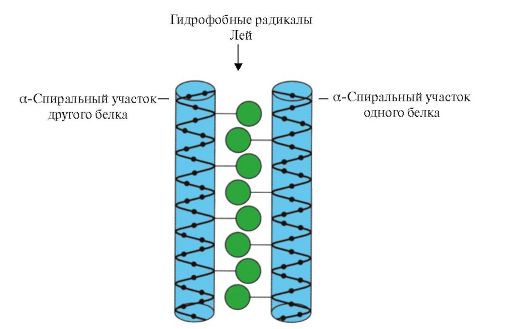 Рис. 1.11. «Лейциновая застежка-молния» между α-спиральными участками двух белков
Рис. 1.11. «Лейциновая застежка-молния» между α-спиральными участками двух белков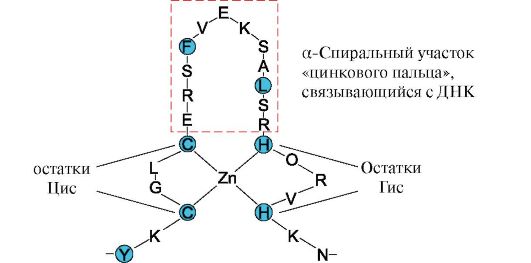 Рис. 1.12. Первичная структура участка ДНК-связывающих белков, формирующих структуру «цинкового пальца» (буквами обозначены аминокислоты, входящие в состав этой структуры)
Рис. 1.12. Первичная структура участка ДНК-связывающих белков, формирующих структуру «цинкового пальца» (буквами обозначены аминокислоты, входящие в состав этой структуры)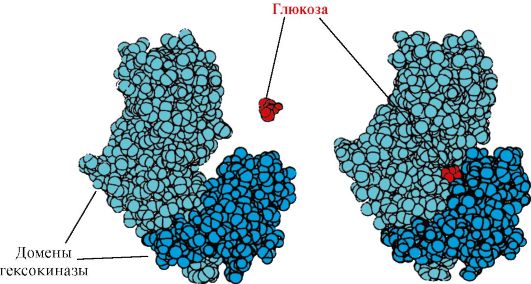 Рис. 1.15. Связывание доменов гексокиназы с глюкозой
Рис. 1.15. Связывание доменов гексокиназы с глюкозой