Если раствор обладает большей электропроводностью, чем чистый растворитель, то это - раствор электролита. Электролиты - это вещества, растворы которых, в отличие от растворов неэлектролитов, проводят электрический ток, так как в растворах электролитов имеются подвижные заряженные частицы (ионы). Процесс распада вещества на ионы при растворении называется электролитической диссоциацией. Основные положения теории электролитов описываются теорией электролитической диссоциации (С. Аррениус, 1887 г.) и теорией сильных электролитов:
1) при растворении вещество полностью или частично распадается на ионы, что и увеличивает электропроводность растворов по сравнению с растворителем;
2)ионы в растворе образуют ионосольваты (ионогидраты) с помощью сил различной природы - от донорно-акцепторных до вандерваальсовых; при этом концентрация свободного растворителя в растворе уменьшается;
3)сильно разбавленные растворы электролитов во многих случаях ведут себя как идеальные, их свойства определяются в основном числом частиц в растворе и не зависят от природы этих частиц;
4)в концентрированных растворах имеет место отклонение от свойств идеальных растворов из-за сильного взаимодействия противоположно заряженных ионов, которые образуют сложные частицы - нейтральные и заряженные, что уменьшает количество частиц по сравнению с тем, что получилось при диссоциации.
Проводимость разбавленных растворов и растворов слабых электролитов пропорциональна концентрации ионов. Поэтому, измеряя электропроводность растворов, судят об их свойствах, зависящих от концентрации ионов.
Количественной характеристикой процесса диссоциации является степень электролитической диссоциации (a):
a = 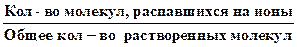 . (6.15)
. (6.15)
По величине a различают сильные (a ³ 0,3) и слабые электролиты. В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами. Например, для реакции диссоциации уксусной кислоты в водном растворе устанавливается равновесие:
 CH3COOH
CH3COOH  CH3COOH- + H+ ,
CH3COOH- + H+ ,
которое количественно характеризуется константой равновесия (в этом случае ее называют константой диссоциации - Кд):
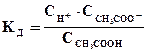 . (6.16)
. (6.16)
Так как 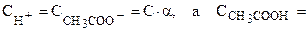 (1 - a)·С
(1 - a)·С
(С - концентрация), то
Кд = 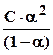 (а) и при a <<1
(а) и при a <<1 
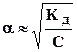 (б) . (6.17)
(б) . (6.17)
ί - изотонический коэффициент или коэффициент Вант-Гоффа., который показывает, во сколько раз увеличивается число частиц электролита в растворе по сравнению с введенной молекулярной формой.
Формулы для расчета коллигативных свойств разбавленных растворов электрполитов с учетом изотонического коэффициента имеют вид:
- осмотическое давление Росм = ί См RT;
- 1-й закон Рауля ΔР / Р(z) = ί Сm ;
- 2-й закон Рауля tкp = ί Ккр Cm; Δtкип = ίКкип Cm.

