Температура, при которой данная жидкость кипит в условиях давления 101325 Па, называют нормальной температурой кипения.
Если растворить в жидкости какое-то вещество, концентрация ее уменьшится и в системе жидкость – твердая фаза усилится процесс плавления. Отсюда вытекает зависимость (II закон Рауля):
Повышение температуры кипения, а также понижение температуры кристаллизации разбавленных растворов прямо пропорционально моляльности раствора и не зависит от природы вещества.
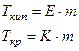
где: 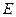 иК – эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, не зависят от природы вещества и концентрации)
иК – эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, не зависят от природы вещества и концентрации)
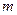 - моляльность раствора.
- моляльность раствора.

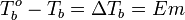 (7.4.3)
(7.4.3)
Здесь: m – моляльность раствора; Е – эбулиоскопическая константа, постоянная для каждого растворителя. Для воды Е = 0,560, что означает – все одномоляльные водные растворы должны начинать закипать при темепературе 100,560С при стандартном давлении.

