ТЕОРИИ СТРОЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Теоретические представления о природе комплексообразования возникли из попыток дать объяснение химическому взаимодействию устойчивых молекул с ионами и атомами различных. Одновременно шел поиск причин заметной неспецифичности таких взаимодействий, в результате чего оказываются прочно связаны между собой и ионы, и атомы, и молекулы. Например, в хлориде дихлороакватриамминкобальта(III) [Co(NH3)3(H2O)Cl2]Cl с комплексообразователем связаны и хлорид-ионы, и нейтральные молекулы аммиака и воды.
Химические связи в комплексных (координационных) соединениях отличаются большим разнообразием, что обусловлено всевозможными сочетаниями ковалентных связей разной полярности, кратности и степени делокализации электронных пар.
В свое время было предложено много различных теорий связи в координационных соединениях, но значительная часть этих теорий уже стала достоянием истории. Мы рассмотрим только 2 теории - метод валентных связей (МВС) и теорию кристаллического поля (ТКП).
Теория валентных связей
Теория валентных связей была первой из квантовохимических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные атомные орбитали своих энергетических уровней.
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей.
Неподеленные пары электронов лигандов взаимодействуют с гибриднымиорбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, образованной по донорно-акцепторному механизму, достаточной прочной и энергетически выгодной. Электронные пары комплексообразователя, в свою очередь, могут взаимодействать с вакантными атомными орбиталямилиганда, упрочняя связь по дативному механизму.
Электронные пары, находящиеся нагибридныхорбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
|
КЧ |
Тип гибридизации |
Геометрия комплекса |
Примеры |
|
|
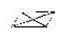
2 |
sp |
линейная |
|
[NH3–Ag–NH3]+ [Cl–Cu–Cl]- |
|
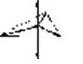
3 |
sp2 |
треугольная |
|
[HgI3] |
|
sp3 |
тригональнаяпирамида |
|
[SnCl3]- |
|
|
4 |
sp3 |
тетраэдр |
|
[Be(OH)4]2[MnCl4]2[Zn(NH3)4]2+ |
|
4 |
dsp2 |
квадрат |
|
[Ni(CN)4]2[PtCl4]2[Pt(NH3)2Cl2]0 |
|
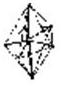
5 |
sp3d(z2) |
тригональная бипирамида |
|
[Fe(CO)5] |
|
5 |
sp3d(x2y2) |
тетрагональная пирамида |
|
[MnCl5]3[Ni(CN)5]3 |
|
6 |
sp3d2, |
октаэдр |
|
[Al(H2O)6]3+[SnCl6]2[Co(NH3)6]3+[Fe(CN)6]3 |
|
7 |
sp3d3 |
пентагональная |
|
[V(CN)7]4 |
Если координационное число принимает большее значение, то конфигурация комплекса сильно усложняется, причем возможно существование нескольких координационных многогранников, взаимно превращающихся друг в друга.
Рассмотрим образование некоторых комплексов с позиций ТВС. Например, катион [Zn(NH3)4]2+ включает комплексообразователь цинк(II).
Электронная оболочка этого условного иона имеет формулу[Ar] 3d10 4s0 4p0 и может быть условно изображена так: Вакантные 4s- и 4p-орбитали атома цинка(II) образуют четыре
sp3-гибридные орбитали, ориентированные к вершинам тетраэдра. Каждая молекула аммиака имеет неподеленную пару электронов у атома азота. Орбитали атомов азота, содержащие неподеленные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II) [Zn(NH3)4]2+: Поскольку в ионе [Zn(NH3)4]2+ нет неспаренных электронов, то он проявляет диамагнитные свойства.
Рассмотрим другой пример -тетракарбонилникель [Ni(CO)4]. Напишем электронную формулу валентного уровня комплексообразователя.
Например, для нейтрального атома никеля: Переход 4s-электронов на 3d-подуровень превращает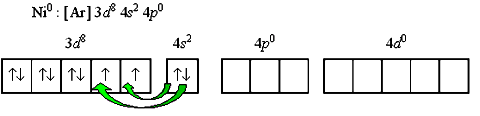
парамагнитный атом Ni0 в диамагнитную частицу Ni* Полученные вакантные орбитали подвергаются гибридизации, образуя тетраэдрическую конфигурацию..JPG)
Если комплексообразователем служит никель(II) с электронной конфигурацией [Ar]3d84s0 4p0, то надобность в перемещении электронов с 4s-подуровня перед гибридизацией отпадает, так как для реализации координационного числа 4 имеется достаточное число вакантныхорбиталей. Такое строение имеет неустойчивый парамагнитный комплекс тетрабромоникколат(II)-ион [NiBr4]2-
Однако при объединении двух электронов 3d-подуровня в пару, и превращении одной из орбиталей этого подуровня в вакантную меняется и тип гибридизации, и характеристика получаемого комплекса.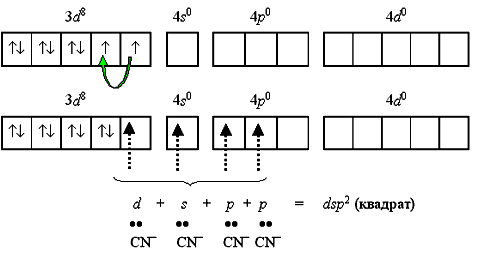
Тип гибридизации dsp2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона [Ni(CN)4]2- (КЧ = 4).
Если в гибридизации участвуют атомные орбиталивнешнегоd-подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым. Строение таких комплексов может отвечать типу гибридизации, например, sp3d2. Такие комплексы, при образовании которых имеет место гибридизация с участием атомных орбиталейпредвнешнегоd-подуровня, называются внутриорбитальными или низкоспиновыми и, как правило диамагнитны или слабо парамагнитны (все или почти все электроны комплексообразователя спарены, а тип гибридизации, например, d2sp3 или dsp2). Например, при рассмотрении комплексов железа(II) обнаруживаются и внешнеорбитальные, и внутриорбитальные комплексы.
Приведенная схема показывает, как образуются парамагнитный высокоспиновыйоктаэдрическийгексафтороферрат(II)-ион [FeF6]4- .JPG)
.JPG)


.JPG)

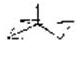

.JPG)
.JPG)