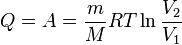ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Тепло  , полученное системой, идет на изменение ее внутренней энергии
, полученное системой, идет на изменение ее внутренней энергии  и совершение работы над внешними телами
и совершение работы над внешними телами  :
: .
.
Первое начало термодинамики — это закон сохранения и превращения энергии применительно к термодинамическим процессам.
Работа внешних тел над системой  связана с работой системы над внешними телами
связана с работой системы над внешними телами  соотношением:
соотношением:  .
.
Работа газа при изобарическом расширении (при расширении с постоянным давлением): .
.
В общем случае работа газа при изменении его объема от  до
до  :
: .
.
Графически работа — площадь криволинейной трапеции на графике  , ограниченная осью абсцисс
, ограниченная осью абсцисс  , прямыми
, прямыми  ,
,  и кривой
и кривой  .
.
Тепло, полученное телом массой  при изменении его температуры на
при изменении его температуры на  :
: , где
, где  — удельная теплоемкость.
— удельная теплоемкость.
Тепло, полученное телом массой  при изменении его агрегатного состояния
при изменении его агрегатного состояния , где
, где  — удельная теплота фазового перехода.
— удельная теплота фазового перехода.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты
, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества
при химическом потенциале
, и работы
[3], совершённой над системой внешними силами и полями, за вычетом работы
, совершённой самой системой против внешних сил
.
Для элементарного количества теплоты  , элементарной работы
, элементарной работы  и малого приращения
и малого приращения 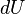 внутренней энергии первый закон термодинамики имеет вид:
внутренней энергии первый закон термодинамики имеет вид:
 .
.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что 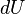 и
и  являются полными дифференциалами, а
являются полными дифференциалами, а  и
и  — нет.
— нет.
Частные случаи
Рассмотрим несколько частных случаев:
- Если
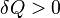 , то это означает, что тепло к системе подводится.
, то это означает, что тепло к системе подводится. - Если
 , аналогично — тепло отводится.
, аналогично — тепло отводится. - Если
 , то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая: в конечном процессе  элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто
элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто  — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
— это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда 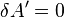 ,
,  ,
,  , выполнение системой работы
, выполнение системой работы  приводит к тому, что
приводит к тому, что 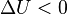 , и энергия системы
, и энергия системы  убывает. Поскольку запас внутренней энергии
убывает. Поскольку запас внутренней энергии  ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:
- при изобарном процессе

- при изохорном процессе (
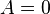 )
)

- при изотермическом процессе