Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП). Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
Как следует из уравнения Нернста, потенциал системы зависит от температуры (предлогарифмический множитель). Наиболее существенно влияние температуры на потенциал окислительно-восстановительных систем, включающих гетерогенную фазу.
Уравнение Нернста:
 ,
,
где
 — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;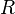 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K); — абсолютная температура;
— абсолютная температура;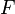 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1; — число молей электронов, участвующих в процессе;
— число молей электронов, участвующих в процессе; и
и 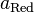 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 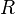 и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим


