Химические источники тока
Химические источники тока (ХИТ) — это такие источники тока, в которых химическая энергия активных веществ при протекании пространственно разделенных окислительно-восстановительных процессов превращается непосредственно в электрическую. Совокупность активных веществ, на основе которых работает химический источник тока, называется электрохимической системой. Она может быть обратимой, когда образовавшиеся в процессе разряда вещества могут быть превращены в первоначальные, и необратимой. когда обратное превращение невозможно.
Химические источники тока делятся на первичные, вторичные и топливные элементы. Источники тока, действие которых основано на использовании энергии необратимых химических систем, называют первичными, одноразовыми элементами. Такие гальванические элементы и их комбинации в обиходе называют батарейками, хотя в технической литературе этот термин относится к батарее из нескольких элементов (англ. cell — элемент, baterry cell — батарея элементов).
Вторичные многоразовые источники тока работают за счет обратимых химических реакций, которые могут происходить в цикле «зарядка — разрядка» до тысячи раз. Одиночные вторичные аккумуляторные элементы и их комбинации обычно называют аккумуляторами. Кроме того, используются аккумуляторные батареи.
Каждый элемент состоит из корпуса электродов и загущенного или твердого электролита. Химические процессы, обеспечивающие образование тока, протекают в электролите (загущенный раствор хлорида аммония) между анодом и катодом.
Системы, образующие анод — катод, могут быть марганцево-цинковыми, воздушно-цинковыми, ртутно-цинковыми (с твердым электролитом). У марганцево-цинковых элементов анодом является цинковый сосуд, а катодом — угольный стержень с выводом наружу, вокруг которого уложен деполяризатор из смеси графита и диоксида марганца. В воздушно-цинковых элементах отрицательным электродом является цинк, положительным — кислород воздуха. Ртутно-цинковые элементы, у которых анодом является оксид ртути, а катодом цинковый порошок, обладают большей емкостью и величиной разрядного тока, чем марганцево-цинковые и воздушно-цинковые элементы.
Гальванический элемент
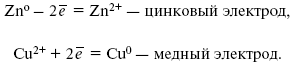
При замыкании внешней цепи электроны переходят от Zn к Cu, происходит диффузия цинка в медь:
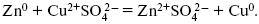
Образуем электрохимическую схему:
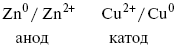
Анод – отрицательный электрод (слева). Катод – положительный электрод.
Для определения ЭДС этого элемента нужно сравнить стандартные электродные потенциалы обоих электродов. При записи электродных реакций принято, что окисленная форма находится в левой части, а восстановленная – в правой части уравнения.
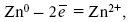
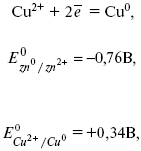
где E0 – электродвижущая сила (ЭДС) гальванического элемента, когда все реагенты в стандартном состоянии.
ЭДС элемента вычисляется вычитанием из потенциала катода потенциала анода.
ЭДС элемента равна +0,34 – (–0,76) = 1,1 В; чем больше электродные потенциалы отличаются друг от друга, тем больше ЭДС. Если погрузить металл в раствор соли большей концентрации, то потенциал нестандартный. Значит, на величину электродного потенциала влияет концентрация и температура. Такая зависимость выражаетсяуравнением В. Нернста.
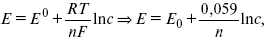
где п – число ионов;
R – универсальная газовая постоянная;
Т – температура;
С – концентрация активных ионов в растворе;
F – число Фарадея = 96500 В.
Аккумуляторы
Электри́ческий аккумуля́тор — источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования, а также для обеспечения резервных источников энергии в медицине, производстве и в других сферах
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде. Несколько аккумуляторов, объединённых в одну электрическую цепь, составляют аккумуля́торную батаре́ю.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в среде серной кислоты. Химическая реакция (слева направо — разряд, справа налево — заряд):
- Анод:



