Электролиз как окислительно-восстановительный процесс
Na+ + e– = Na0
Cl– – e– = Cl0
2NaCl —> 2Na+ + 2Cl– —электролиз—> 2Na0 + Cl20
Законы Фарадея
Электролизомназывают процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты.
При электролизе на электродах непрерывно протекают окислительно-восстановительные реакции. На катоде (К(-)) происходит процесс восстановления, на аноде (А(+)) – процесс окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Течение первичных анодных и катодных реакций подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
m = kQ, но Q =It (9.16)
где I – сила тока, А; t – время пропускание тока, с.
m = kIt (9.17)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
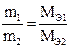
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
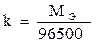
Подставив последнее уравнение в (9.17), получим формулу, объединяющую оба закона Фарадея.
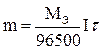 (9.18)
(9.18)
Соотношение (9.18) используют в расчетах процессов при электролизе. При практическом проведении электролиза всегда некоторая часть электрической энергии затрачивается на побочные процессы. Важной характеристикой рентабельности установки для проведения электролиза (электролизера) является выход по току (h, %):
h = 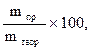 (9.19)
(9.19)
где mпр – масса фактически выделенного вещества; mтеор – масса вещества, которая должна была выделиться в соответствии с законом Фарадея.
На процесс электролиза существенно влияет плотность тока, то есть сила тока, приходящаяся на единицу рабочей поверхности электрода.
Рассмотрим процессы, протекающие на катоде и аноде. Если электролиз идет в расплаве соли, то на катоде выделяется металл, а на аноде газ аниона.
Электролиз расплавов электролитов
Схема записи электролиза расплава электролита:
KtAn ↔ Ktn+ + Anm–
Катод– | Ktn+ + bē → B0 | b | c
Анод+ | Anm– – cē → C0 | c | b
cKtn+ + bAnm– → cB0 + bC0 (ионное уравнение)
KtAn → cB0 + bC0 (молекулярное уравнение)
Пример 1. Составьте уравнения и опишите процессы, протекающие на электродах при электролизе расплава хлорида магния.
MgCl2 ↔ Mg2+ + 2Cl–
Катод– | Mg2+ + 2ē → Mg0 | 2 | 1
Анод+ | 2Cl– – 2ē → Cl20 | 2 | 1
Mg2+ + 2Cl– → Mg0 + Cl20
MgCl2 → Mg0 + Cl20
Пример 2. Составьте уравнения и опишите процессы, протекающие на электродах при электролизе расплава гидроксида железа (II).
Fe(OH)2 ↔ Fe2+ + 3OH–
Катод– | Fe2+ + 2ē → Fe0 | 2 | 4 | 2
Анод+ | 4OH– – 4ē → 2H2O + O20 | 4 | 2 | 1
2Fe2+ +4OH– → 2Fe0 + 2H2O + O20
Fe(OH)2 → 2Fe0 + 2H2O + O20
Электролиз растворов отличается от электролиза расплавов электролитов наличием молекул воды, которые также могут участвовать в окислительно-восстановительных реакциях электролиза. Вследствие своей биполярности молекулы воды ориентируются как у катода, так и у анода (диссоциации молекул на ионы практически не происходит). Процессы, происходящие с молекулами воды можно выразить следующими уравнениями:
Катод– | Н2О + 2ē → Н20 + 2ОН–
Анод+ | 2Н2О – 4ē → О20 + 4Н+
В виду одновременного присутствия в растворах около электродов ионов электролита и молекул воды, они будут конкурировать между собой:
Катод– | Н2О ↔ Ktn+
Анод+ | 2Н2О ↔ Anm–
То, какая из частиц восстановиться на катоде (вода или катион) или окислиться на аноде (вода или анион), определяется при сравнении величин их электродного потенциала.
На катоде восстанавливается частица, имеющая наиболее положительный потенциал, а другая частица остается в растворе без изменения. На аноде окисляется частица, имеющая наиболее отрицательный потенциал, а другая частица остается в растворе без изменения.
Схема записи электролиза водного раствора электролита:
KtAn ↔ Ktn+ + Anm–
Катод– | Ktn+ ; Н2О | Ktn+ + bē → B0 |
Электролиз водных растворов солей
Катодный процесс:
1. Если электродный потенциал металла существенно более отрицателен, чем потенциал водородного электрода (ниже -1 В), то на катоде восстанавливается водород, т.е., при конкуренции катиона металла, находящегося в ряду напряжений в группе с Li по Al (включительно), и молекул воды, на катоде восстанавливается вода
Н2О + 2ē → Н20 + 2ОН–;
2. Если электродный потенциал металла более положителен, чем потенциал водородного электрода (выше 0 В), то на катоде разряжаются ионы металла, т.е., при конкуренции катиона металла, находящегося в ряду напряжений в группе металлов после водорода, и молекул воды на катоде восстанавливается металл;
3. Если электродный потенциал металла имеет отрицательное значение, но не ниже -1 В, то его ионы могут восстанавливаться на катоде одновременно с ионами водорода из воды, т.е., при конкуренции катиона металла, находящегося в ряду напряжений в группе металлов после алюминия и до водорода, и молекул воды на катоде восстанавливается и металл и вода. Однако, подбирая условия (рН раствора, плотность тока, соответствующие электроды) можно добиться восстановления только ионов металла.
Cs______________Al Mn_______________________________Pb H Cu_________________Au

