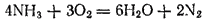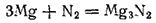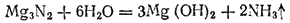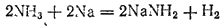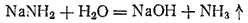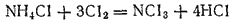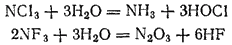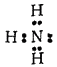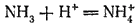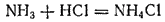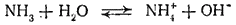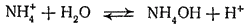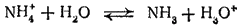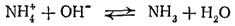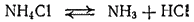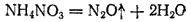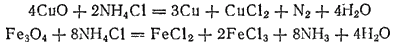1.
ОВР- Реакции в которых окисленность эл-ов измен-ся.
Zn+2HCl=ZnCl2+H2
ОВР-фотосинтез, дыхание,пищевар.металлургия.
Отдача эл-ов с повышением степень окисления- окислительный. Прединение с пониж степ- восстановление.В-во с окисляющим элементом-вос-ль ( соедин с низшими степ окис, присущих данному эл-ту (Ме), с востанав-им- окис-ль (Высш).
Существуют два метода составления ОВР - метод электронного0баланса и метод полуреакций.
В 1 методе сравнивают степени окисления атомов в исход-х в-вах и в продуктах р-и, при этом руковод-ся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для сос-ия уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
HCl + MnO2 Cl2 + MnCl2 + H2O Cl2 + MnCl2 + H2O |
| |
|
1.Указываем степени окисления химических элементов.

|
|


При написании продуктов реакции необходимо учитывать характер среды. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов – хлориды, бромиды, сульфаты, нитраты.
В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Полураекци метод.
КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ РЕАКЦИЙ
Все окислительно-восстановительные реакции можно разделить на 3 группы:
1. РЕАКЦИИ МЕЖАТОМНОГО И МЕЖМОЛЕКУЛЯРНОГО ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ
В реакциях данного типа перемещение электронов осуществляется между различными молекулами, атомами или ионами, т.е. окислитель и восстановитель являются различными веществами, например
MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
Здесь MnO2 – окислитель, HBr — восстановитель
2. РЕАКЦИИ ВНУТРИМОЛЕКУЛЯРНОГО ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ.
В реакциях такого типа перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы), например
2AgNO3 = 2Ag + 2NO2 + O2
Здесь Ag+1 – окислитель, O-2 – восстановитель.
3. РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ (РЕАКЦИИ САМООКИСЛЕНИЯ-САМОВОССТАНОВЛЕНИЯ).
В реакциях этого типа окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления, например
3HNO2 = HNO3 + 2NO + H2O
Здесь N+3 (в молекуле HNO2) является и окислителем и восстановителем.
Наиболее распространенными и многообразными являются реакции первого типа (межатомного и межмолекулярного окисления-восстановления).
Как и для реакций обмена, для окислительно-восстановительных реакций возможно протекание в различных средах
• В растворах
3Na2SO3 + K2Cr2O7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
• В газообразном состоянии
4NH3 + 3O2 = 2N2 + 6H2O
• C участием твердых веществ
5Ca + Nb2O5 = 5CaO + 2Nb
|
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html#more-1094
аммиак — бесцв газ с харак-ым резким запахом.
В лаборатории аммиак обычно получают, нагревая хлорид аммония NH4Cl с гашеной известью Ca(OH)2. Реакция выражается уравнением
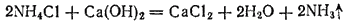
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
Масса 1 л аммиака при норм усл 0,77 г.Т.к. газ знач-но легче воздуха, его можно собирать в перевернутые вверх дном сосуды.
При охлаждении до -33,4* аммиак под обычным давлением превращается в прозрачную жидкость, затвердевающую при -77,8*
.
 sp3. неподел эл-я пара, способна к новым образ-ям по донрно-акц.
sp3. неподел эл-я пара, способна к новым образ-ям по донрно-акц.
В жидком аммиаке молекулы связаны водородными связями, что обусловливает сравнительно высокую температуру кипения аммиака-33,4, не соответствующую его малой молекулярной массе (17).
Аммиак оч хорошо раст-им в воде: 1 объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25%(масс.) NH3 и имеет плотность 0,91 г\см3. Раствор аммиака в воде -нашатырным спиртом. нашатырный спирт содержит 10% NH3. С повышением t, раст-ть уменьшается, поэтому он выделяется при нагревании из конц раствора, чем иногда пользуются в лаб для получения небольших кол-в газ-го аммиака.
При низкой температуре из раствора аммиака может быть выделен кристаллогидрат NH3*H2O, и кристаллогидрат состава 2NH3*H2O. молекулы воды и ам-ка водородными связями.
ХИМ активен; он вступает во взаим-е со многими веществами. В аммиаке азот имеет самую низкую степ окис. Поэтому аммиак только вос-ль . Если пропускать ток NH3 по трубке, вставленной в другую трубку , по которой проходитO2, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот:
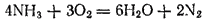
При других условиях аммиак может окисляться до NO
аммиак не обладает кис-ми св-ми. Однако атомы водорода в его молекуле могут замещаться атомами ме. При полном замещении H2 металлом - нитриды. Некоторые(нитриды Ca и Mg) получаются при непосред-ом взаим-и азота с ме при высокой t;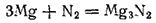
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла. Например:
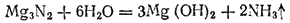
При замещ-и в мол аммиака только 1го атома H2 металлами образуются амиды ме-лов. Так, пропуская NH3 над расплав-ым Na-амид натрия в виде бесцв крист:
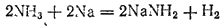
Вода разлагает амид натрия;
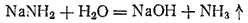
H2 в NH3 может замещ-ся галогенами. Так, Cl2 +конц раствор хлорида аммония =нитрид хлора, или хлористый азот.-тяжелой маслян-й взрывчатой жидкости.
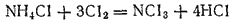
Подобными же св-ми обладает нитрид иода (иодистый азот), С фтором азот образует устойчивый фторид азота.
электроотр-ть хлора и йода меньше, а фтора больше, чем эл-ть азота=> в соедин-х NCl3и NI3 степ окис —3, а в NF3+3. Поэтому фторид азота отличается по свойствам от нитридов хлора и иода. Например, водa+ NCl3и NI3 = аммиак, а в случае NI3 = оксид азота(III);
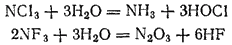
Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподеленную электронную пару:
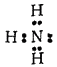
Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно-акцепторному способу четвертой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами.
Этим объясняется чрезвычайно характерная для аммиака способность вступать в реакции присоединения.
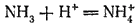
В этой реакции аммиак служит акцептором протона и, следовательно,проявляет св-ва основания. реагируя с кислотами, аммиак нейтрализует их, образуя соли аммония. Например, с соляной кислотой получается хлорид аммония :
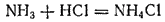
NH3 + H2Oтоже приводит к образованию не только гидратов аммиака, но частично и иона аммония:
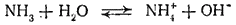
В результате концентрация ионов OH- в растворе возрастает. Именно поэтому водные растворы аммиака обладают щелочной реакцией. Однако р-р аммиака обозначают формулой NH4OH и называют гидроксидом аммония, а щелочную реакцию этого раствора рассматривают как результат дисс-ции молекул NH4OH.
Аммиак — слабое основание. При 18* константа равновесия его ионизации равна 1,8*10-5.
Больши-во солей аммония бесцв и хор раст-мы в воде.
Т.к. водный р-р аммиака -слабое осн, то соли аммония в р-рах гидролизуются. Р-ры солей, образованных аммиаком и сильными кис-ми, имеют слабокислую реакцию.
Гидролиз иона аммония обычно записывают в такой форме:
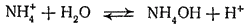
Однако правильнее рассматривать его как обратимый переход протона от иона аммония к молекуле воды:
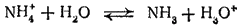
При добавлении щелочи к водному р-ру какой-либо соли аммония ионы H3O связ-ся ионами ОН- в молекулы воды и равн-е гидролиза смещ вправо.
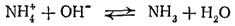
При нагревании р-ра аммиак улетуч-ся, запах. Т. обр., присутствие любой аммонийной соли в р-ре можно обнаружить, нагревая раствор со щелочью (реакция на ион аммония).
Соли аммония термически неустойчивы. При нагрев они разлаг. Это разлож-е может обратимо или необратимо. Соли аммония, анион которых не является окисл-ем или лишь в слаб степени проявляет окис-ые св-ва, распад-ся обратимо.
на холодных частях сосуда вновь соединяются в хлорид аммония:
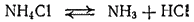
При обратимом распаде солей аммония, обр-ых нелетучими кис-ами, улетучивается только аммиак. Однако продукты разложения — аммиак и кислота, — будучи смешаны, вновь соедин-ся друг с другом. Примерами могут служить реакции распада сульфата аммония или фосфата аммония .
Соли аммония, анион которых проявляет более резко выраженные окислительные свойства, распадаются необратимо: протекает ОВР, в ходе которой ион аммония окис-ся, а анион восстан-ся. Пример-разложение нитрата аммония:
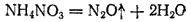
Сульфат аммония (NH4)2SO4/ Нитрат аммония NH4NO3
Хлорид ам-я, нашатырь, NH4Cl- способствует удалению с пов-ти ме оксидных пленок. При соприкос-ии сильно нагретого ме с хлоридом аммония оксиды, наход-ся на пов-ти ме, либо восстанавливаются, либо переходят в хлориды, которые улетуч-ся с пов-ти ме.
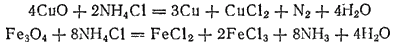
Получение аммиака
В промышленности получение аммиака связано с прямым его синтезом из простых веществ. Как уже отмечалось, источником азота служит воздух, а водород получают из воды.
3H2 + N2 -> 2NH3 + Q
Реакция синтеза аммиака обратима, поэтому важно подобрать условия, при которых выход аммиака в химической реакции будет наибольшим. Для этого реакцию проводят при высоком давлении (от 15 до 100 МПа). В ходе реакции объёмы газов (водорода и азота) уменьшаются в 2 раза, поэтому высокое давление позволяет увеличить количество образующегося аммиака. Катализатором в такой реакции может служить губчатое железо. При этом интересно то, что губчатое железо действует как катализатор только при температуре выше 5000C. Но увеличение температуры способствует распаду молекулы аммиака на водород и азот. Для избежания распада молекул, как только смесь газов проходит через губчатое железо, образовавшийся аммиак сразу охлаждают! Кроме того при сильном охлаждении аммиак превращается в жидкость.
Получение аммиака в лабораторных условиях производят из смеси твёрдого хлорида аммония (NH4Cl) и гашенной извести. При нагревании интенсивно выделяется аммиак.
2NH4Cl + Ca(OH)2 -> CaCl2 + 2NH3 + 2H2O



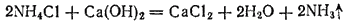

 sp3. неподел эл-я пара, способна к новым образ-ям по донрно-акц.
sp3. неподел эл-я пара, способна к новым образ-ям по донрно-акц.