2. 2SO2+O2=2SO3 (t,кат)
Свободные молекулы SO3 - бесцветн, лёгкоподвижн жид, в присутствии следов влаги кристаллизуется. построенны в форме правильного треуг. В центре атом Серы. Атом S в sp2 г-ии. => ядра 4ёх атомов в одной плоскости, а валентные угла 120*. Атом S связан с O2 тремя двухцентровыми сигма связ, и одной четырёхцентровой Пи-связью.

пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между всеми тремя связями . Эта электронная пара принадлежит всем четырем атомам,— четырехцентровая.
За счёт 2p-неподелённых пар кислорода и и свободных 3d-орбиталей серы, возможно образ-е доп-х ков-ых связей. триоксид сер-ангидрид серной кис-ты.
SO3+H2O=H2SO4+88кДж 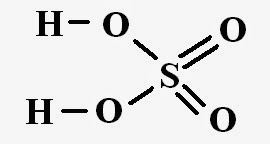
Безводная серн кис-та-бесцв, маслянистая жид, кристаллизующаяся при 10,3*
При нагреве безводн серн кс отщипляет SO3 .который улетучивается, до получения р-ра с 98,3% H2SO4, 1,7% H2O. Этот азеотропный раствор кипит, перегоняетсябез изменения сост при 338,8*. Азеотропный р-р получается и при перегонке разб серн кс, в этом случает отгоняется приемущ-но вода.¬
При растворении серн кс в воде = гидраты и оч большое кол-во Q.
Серн кс жадно поглащает пары воды, поэтому применяется для осушения газов. Серн кс конц обугливает многие орг в-ва особен-но углеводов.
Конц серн кс, особенно горяч-сильн окис-ль , Окисляет HI и HBr (но не HCl ) до галогенов, уголь до СО2, серу до SO2.
8HI+H2SO4=4I2+H2S+4H2O C+2H2SO4=CO2+2SO2+2H2O S+H2SO4=3SO2+2H2O
С Ме взаим-ет зависимо от конц. Разбавленная окисляет до Н2. Поэтому взаимодействует с Ме, стоящими до Н2. кроме Pb. Zn+H2SO4=ZnSO4+H2.
Конц сер кс окисляет Ме до Ag включительно. С малоактив Ме до SO2. Cu + 2H2SO4 → SO2+2H2O+SO42-+Cu2+.. С более актив, мб и SO2 и S, H2S.
2H2SO4+Zn=ZnSO4+SO2+2H2O
4H2SO4+3Zn=3ZnSO4+S+4H2O
Fe (тв) + H2SO4 (водн) → H2 (газ) + FeSO4 (водн)
Серная кис-та - сильная двухосновная. На 1ой ступени дис-ет практич-и нацело.
Как ки-ты двухосновная образует 2 ряда солей. сред-сульфты, кисл-гидросульфаты.
больш-во солей серн кис-ты растворимы в воде. Практически не расстворимы сульфаты бария,стронция,свинца. Малорастворимкальция. Сульфат бария нерастворим не только в воде но и в кислотах. Поэтому белого нерастворимого осадкапри действии на раст-р солью бария служит указанием на ионы SO4.
Важнейшие соли Na2SO4*10H2O-глауберова соль. KSO4-бесцветн кристалы, хорош раст-мы, MgSO4 в морск воде, СaSO4-гипс CaSO4*2H2O. При нагреве до 150-170* переходит в алебастр (2СaSo4*H2O) с водой затверд.
Купоросы- кристаллы железа.меди,цинка, др ме, содержащих кристаллиционную воду. Медный СuSO4*5H2O, железный, FeSO4*7H2O
Квасцы- двойные соли Al2(SO4)3*K2SO4*24H2O or KAl(SO4)2-алюмокалиевые квасцы, бесцв. сущ в тв виде. МОгут входить трёхвалент-е ме.

