Заселение атомных орбиталей электронами определяется правилом минимума энергии, принципом Паули и правилом Хунда.
Электроны заселяют атомные орбитали, начиная с подуровня с меньшей энергией. В этом состоит правило минимума энергии. Последовательность в нарастании энергии подуровней акова: 1s < 2s < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s и так далее …
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства - т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра.
Электроны в атоме занимают самые энергетически выгодные атомные орбитали (орбитали с минимальной энергией), образуя электронные облака определенной формы.
В случае s-орбитали электронное облако сферическое:
В случае p-орбиталей форма электронного облака гантелеобразная
Внутри атомных орбиталей вероятность нахождения электронов велика; иными словами, имеется высокая электронная плотность. Пространство вне объема орбиталей соответствует малой электронной плотности.
В каждой атомной орбитали может размещаться максимально два электрона (принцип Паули).
При наличии орбиталей с одинаковой энергией (например, трех р-орбиталей одного подуровня) каждая орбиталь заполняется вначале наполовину (и поэтому на р-подуровне не может быть более трех неспаренных электронов), а затем уже полностью, с образованием электронных пар (правило Хунда).
Для изображения электронной конфигурации атома нужно распределить его электроны по подуровням так, чтобы каждой атомной орбитали соответствовала одна квантовая ячейка, и в соответствии с тремя указанными правилами заселения.
энергетический подуровень-совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел.энергетический подуровень обознач лат. буквами:s,p,d,f и т.д. например, n = 2,1 = 0,1. знач, на 2 уровне есть подуровень s(1 = 0)и подуровень р(1 = 1).
ПЕРВОЕ ПРАВИЛО КЛЕЧКОВСКОГО .
При увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы.
ВТОРОЕ ПРАВИЛО КЛЕЧКОВСКОГО.
При одинаковых значениях n+l заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа
Правило Клечковского не для всех атомов описывает правильно электронную конфигурацию. Например 24Cr 1s22s22p63s23p64s23d4 (должно быть), 4s'3d5 (на самом деле).
Это явление называется «провал электронов» и объясняется тем, что более устойчивым атом является тогда, когда число на d-орбитали приближается к 5 или 10. В этом случае и происходит переход e c s – на d. –орбиталь.
К s-элементам относят элементы IA-группы – щелочные металлы. Электронная формула валентной оболочки атомов щелочных металлов ns1. Устойчивая степень окисления равна +1. Элементы IА-группы обладают сходными свойствами из-за сходного строения электронной оболочки
Атомы щелочных элементов легко отдают свой валентный электрон, что характеризуют их как сильные восстановители.
Восстановительные свойства усиливаются с возрастанием порядкового номера.
К p-элементам относятся 30 элементов IIIA-VIIIA-групп периодической системы; p-элементы расположены во втором и третьем малых периодах, а также в четвертом—шестом больших периодах. Элементы IIIА-группы имеют один электрон на p-орбитали. В IVА-VIIIА-группах наблюдается заполнение p-подуровня до 6 электронов. Общая электронная формула p-элементов ns2np6. В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах радиусы атомов увеличиваются. От 2p-элементов к 6p-элементам энергия ионизации уменьшается. Усиливаются металлические свойства p-элемента в группе с увеличением порядкового номера.
К d-элементам относятся 32 элемента периодической системы IV–VII больших периодов. В IIIБ-группе у атомов появляется первый электрон на d-орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов.
Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
_______
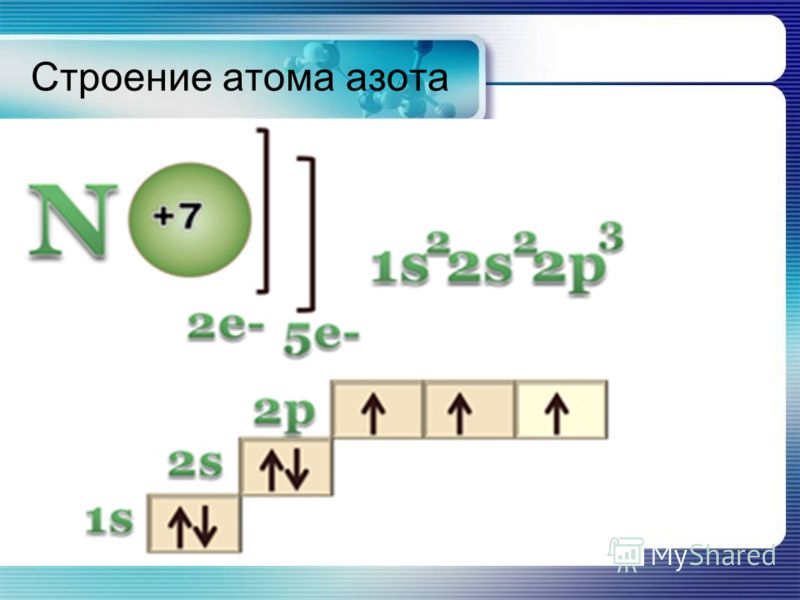
2. Большая часть N2 находится в природе в свободном сост. Свобод-й азот явл главной сост-й частью воздуха, который содержит 78,2% азота. Неорг-е соедин-я азота не встр-ся в природе в больших кол-ах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана. Почва содержит незнач-ые кол-ва азота, преимущ-но в виде солей азотной кислоты. Но в виде сложн орг соед-й — белков — азот входит в состав всех жив oрг. Общее содержание азота в земной коре 0,04%.
 Степень окис N-3H3 ,N2-2H4 , N-1H2OH, N20, N2+1O, N+2O,HN+3O2, N+4O2,HN+5O3/
Степень окис N-3H3 ,N2-2H4 , N-1H2OH, N20, N2+1O, N+2O,HN+3O2, N+4O2,HN+5O3/
Получение азота из воздуха сводится к отделению его от кислорода. В промышэто осущ-ся путем испарения жидкого воздуха в спец установках.
В лаб-ях обычно пользуются азотом, поставляемым в баллонах под повышенным давлением или в сосудах Дьюара. Можно получать азот разлож-ем некоторых его соед, например нитрита аммония NH4NO2, который разлагается при небольшом нагревании:
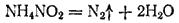
В молекуле N2 атомы связаны тройной связью. Энергия диссоциации этой молекулы очень велика (945 кДж/моль), поэтому термическая диссоциация азота делается заметной лишь при очень сильном нагревании (при 3000* диссоциирует около 0,1%).
Азот — бесцв газ,без запаха, мало раст-й в воде. немного легче воздуха: масса 1 л азота равна 1,25 г.
Молекулярный азот — химически малоакт в-во. При комнатной t он взаимодействует лишь с литием. Малая актив азота объясняется большой прочностью его молекул, обусловливающей высокую энергию активации реакций, протекающих с участием азота. Однако при нагревании он начинает реагировать со многими металлами — с магнием, кальцием, титаном. С H2 азот вступает во взаимодействие при высоких температуре и давлении в присутствии катализатора. Реакция азота с кислородом начинается при 3000-4000*.
Основное применение азот в качестве исход продукта для синтеза аммиака и некоторых других соед-й. Кроме того, он примен-ся для заполнения электрических ламп, для создания инертной среды при промышленном проведении некоторых химич реакций, при перекачке горючих жидкостей.
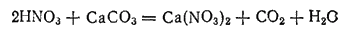
Некоторая часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется при горении орг в-в. Кроме того, существуют бактерии, которые при недост-ом доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих денитрифицирующих бактерий приводит к тому, что часть азота из доступной для зеленых растений формы (нитраты) переходит в недоступную (свободный азот). Т. обр., далеко не весь азот, вход-й в состав погибших растений, возвращается в почву; часть его постепенно выдел-ся в свободном виде.
Непре-ая убыль мин-ых азотных соед-ий давно должна была бы привести к полному прекращению жизни на Земле, если бы в природе не существовали процессы, возмещающие потери азота. К таким процессам относятся прежде всего происходящие в атмосфере электрические разряды, при которых всегда образуется некоторое кол-во оксидов азота; последние с водой дают азотную кислоту, превращающуюся в почве в нитраты. Другим источ попол-я азотных соедин почвы явл жизнедеятельность азотобактерий, способных усваивать атмосферный азот. Усваивая атмосферный азот, клубеньковые бактерии перерабатывают его в азотные соединения, а растения, в свою очередь, превращают последние в белки и другие сложные в-ва.
Т. обр., в природе совершается непрер-ый круговорот азота.