-
Классификация органических реакций
Каждая органическая реакция приводит к образованию соответствующих продуктов, т.е. характеризуется определенным направлением. С другой стороны, образование продуктов реакции протекает обычно через специфические для данной реакции промежуточные стадии. Поэтому органические реакции классифицируют по направлению (1), механизму (2) и молекулярности (3).
-
По направлению и конечному результату ( по суммарному изменению происходящему в исходных молекулах) различают следующие реакции:
Реакции присоединения:

Реакция отщепления:

Реакция замещения:

Перегруппировки:
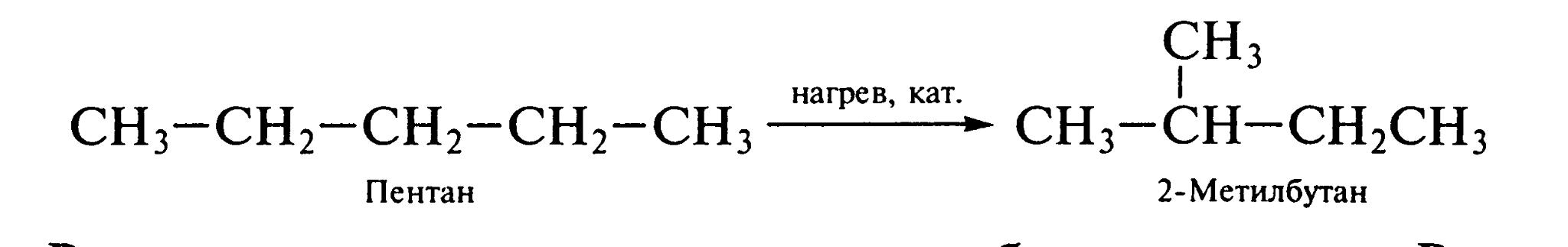
-
По характеру реагирующих частиц и типу разрыва ковалентной связи реакции могут быть гомолитическими и гетеролитическими.
Гомолитические (радикальные) реакции сопровождаются гомолитическим разрывом ковалентной связи. Реагентами (как и промежуточными частицами) в таких реакциях обычно являются радикалы (частицы с неспаренным электроном), либо молекулы легко разрушающиеся до радикалов в условиях реакции, или атомы. Новая связь при этом образуется за счет электронов и реагента, и субстрата.

Условия осуществления гомологических реакций включает газовую фазу или неполярный растворитель, высокие температуры или воздействие светом (излучение) высокой энергии.
Гетеролитические (ионные, полярные) реакции сопровождаются гетеролитическим разрывом связи. В отличие от гомолитических такие реакции протекают в полярной среде при умеренных температурах и нередко требуют присутствия катализатора.
Гетеролитические реакции по характеру реагента подразделяются на два типа:
Нуклеофильные реакции, в которых образование новой связи осуществляется за счет электронов регента (нуклеофила):

Приведенная выше схема гидролиза галагеналканов является примером реакции нуклеофильного замещения - SN;
Электрофильные реакции, в которых образование новой связи осуществляется за счет электронов субстрата; реагент – электрофил.

Взаимодействие галогенов с алкенами – пример реакции электрофильного замещения AE . электрофильное замещение SE происходит при взаимодействии бензола с азотной кислотой в присутствии серной (атакующая частица – катион нитрония):
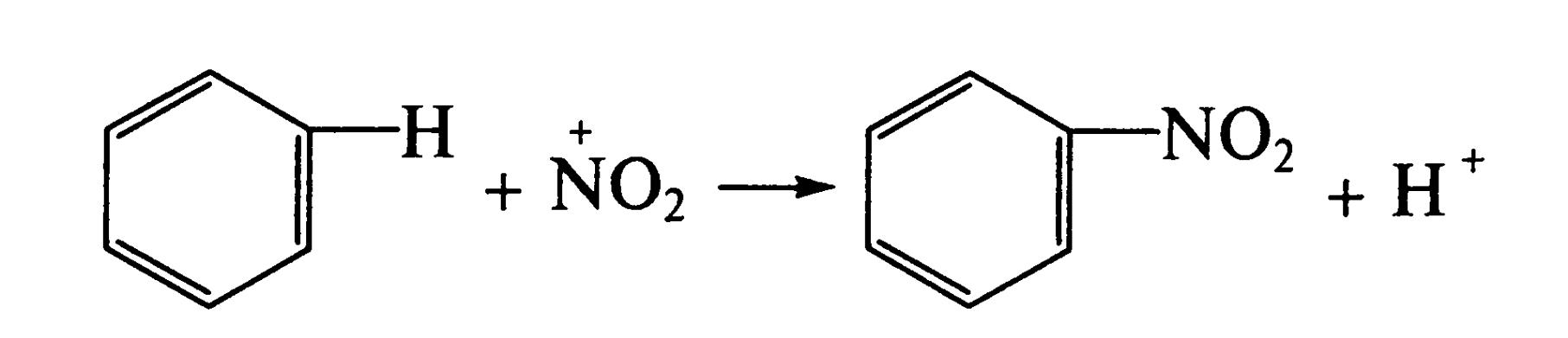
-
Замещение в пиридине.
Электрофильное замещение в пиридине.
В реакциях электрофильного замещения пиридин ведет себя подобно сильно дезактивированному производному бензола. Он нитруется, сульфируется и галогенироуется в очень жестких условиях, а в реакцию Фриделя – Крафтса совсем не вступает.
Замещение происходит главным образом в положении 3

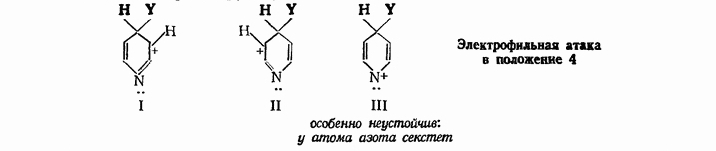
Попытаемся объяснить реакционную способность и ориентацию, используя обычный подход, основанный на рассмотрении устойчивости промежуточного карбониевого иона. Атака в положении 4 дает карбониевый ион, представляющий собой гибрид структур I, II и III.
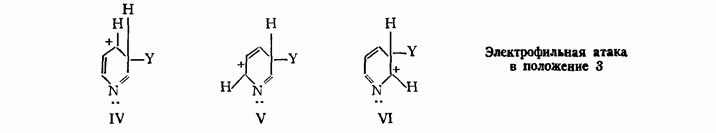
Атака в положении 3 приводит к получению иона, представляющего собой гибрид структур IV, V и VI
(Атака в положении 2 сходна с атакой в положении 4, так же как атака в орто-положение в ряду бензола с атакой в пара-положение).
Все эти структуры менее устойчивы, чем соответствующие структуры возникающие при атаке бензольного ядра, поскольку атом азота оттягивает к себе электроны. Поэтому пиридин медленнее, чем бензол реагирует в реакциях электрофильного замещения.
Из числа приведенных структур структура III особенно неустойчива, поскольку в ней электроотрицательный атом имеет лишь секстет электронов. Поэтому атака в положении 4 (или в положении 2) осуществляется особенно медленно и замещение происходит преимущественно в положении 3.
Различия между реакциями замещения в пиридине и пирроле. В случае пиррола структура в которой атом азота несет положительный заряд, особенно устойчива, поскольку каждый атом в ней имеет октет электронов; атом азота приобретает положительный заряд вследствие обобществления четырех пар электронов. В случае пиридина наиболее неустойчива структура, в которой атом азота несет положительный заряд (III), поскольку атом азота в этой структуре имеет лишь секстет электронов; атом азота легко обобществляет свои электроны, но будучи электроотрицательным, он не склонен отдавать свои электроны.
Нуклеофильное замещение в пиридине.
В реакциях нуклеофильного замещения, как и в реакциях электрофильного присоединения, кольцо пиридина ведет себя аналогично бензольному кольцу, содержащему сильную электроноакцепторную группу. Нуклеофильное замещение протекает легко, особенно в положение 2 и 4, например:
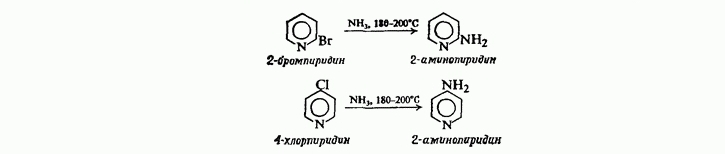
Реакционная способность пиридина в реакциях нуклеофильного замещения настолько велика, что замещению может подвергаться даже сильно основный гидрид-ион :H-. Два важных примера подобной реакции — аминирование амидом натрия (реакция Чичибабина) и алкилирование или арилирование при помощи литийорганических соединений
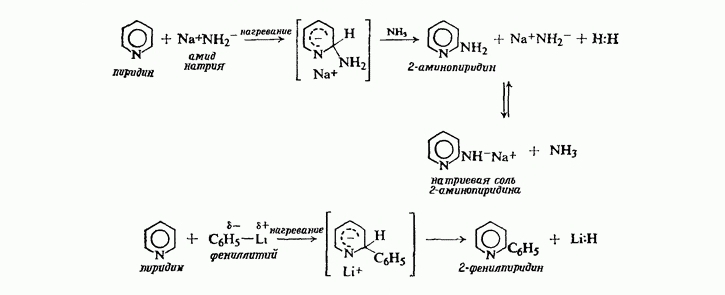
Как мы уже убедились, механизм нуклеофильного замещения в ароматическом ряду вполне аналогичен механизму электрофильного замещения. Реакция включает две стадии; скорость первой стадии — образование заряженной частицы — определяет скорость суммарной реакции. В электрофильном замещении интермедиат заряжен положительно; в нуклеофильном замещении интермедиат заряжен отрицательно. Способность кольца размещать заряд определяет стабильность промежуточного соединения и переходного состояния, приводящего к его образованию, и, следовательно, определяет скорость реакции.
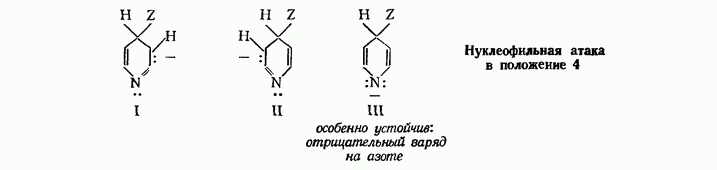
Нуклеофильная атака в положение 4 приводит к карбаниону, представляющему собой гибрид структур I, II и III
Атака в положение 3 дает карбанион, представляющий собой гибрид структур IV, V и VI
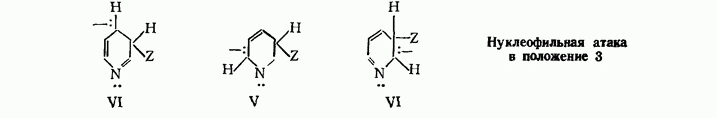
(Атака в положение 2 напоминает атаку в положение 4.)
Все эти структуры гораздо более устойчивы, чем соответствующие структуры, образующиеся при атаке производных бензола, что связано с электроно-акцепторным влиянием атома азота. Структура III особенно устойчива, поскольку в ней отрицательный заряд локализован на атоме, который более всего склонен его принимать, — на электроотрицательном атоме азота. Поэтому понятно, что нуклеофильное замещение протекает быстрее для пиридинового кольца по сравнению с бензольным и быстрее в положения 2 и 4, чем в положение 3.
Одна и та же причина — электроотрицательность атома азота — обусловливает малую реакционную способность пиридина в реакциях электрофильного замещения и его высокую активность в реакциях нуклеофильного замещения.
-
Образец нитробензола массой 85 г, содержащий 7% примесей, восстановили до анилина; выход реакции равен 85%. Вычислите массу образовавшегося анилина.

