{66}
реакции аминокилост по карбоксильной группе
Декарбоксилирование
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
.gif)
Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
.gif)
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
.gif)
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
.gif)
Реакция используется для активации аминогруппы в синтезе пептидов.
{68}
Пептиды.
Номенклатура пептидов Аминокислотный остаток пептидов, несущий своб. a-аминогруппу, наз. N-концевым, а несущий своб. a-карбоксильную группу - С-концевым. Название пептида образуется из назв. входящих в его состав аминокислотных остатков, перечисляемых последовательно, начиная с N-концевого. При этом используют тривиальные назв. аминокислот, в которых окончание "ин" заменяется на "ил"; исключение C-концевой остаток, назв. которого совпадает с назв. соответствующей аминокислоты. Все аминокислотные остатки, входящие в пептид, нумеруются, начиная с N-конца. Для записи первичной структуры пептида (аминокислотной последовательности) широко используют трехбуквенные и однобуквенные обозначения аминокислотных остатков (напр., Ala Ser -Asp Phe -GIy аланил-серил-аспарагил-фенилаланил-глицин).
Классификация пептидов Все пептиды делятся на гомомерные и гетеро-мерные. Гомомерные пептиды при гидролизе образуют только аминокислоты, гетеромерные наряду с аминокислотами соед. др. классов. В зависимости от структуры неаминокислотной компоненты, гетеромерные пептиды делятся на глико-, липо-, нуклео-, фосфопептиды и др. Гомомерные и гетеромерные пептиды могут быть линейными и циклическими. Аминокислотные остатки в них м.б. соединены между собой только пептидными связями (гомодетные пептиды) или не только пептидными сложноэфирными, дисульфидными и др. (гетеродетные пептиды). Гетеродетные пептиды с встроенными в цепь гидроксиаминокислотами наз. пептолидами. пептиды, содержащие в молекуле остатки только одной аминокислоты, наз. гомополиаминокислотами, а содержащие одинаковые повторяющиеся участки (из одной или неск. аминокислотных остатков) регулярными пептидами. Особую группу гетеромерных гетеро-детных пептидов образуют депсипептиды.
Строение. Пептидная связь имеет свойства частично двойной связи. Это проявляется в уменьшении длины этой связи (0,132 нм)по сравнению с длиной простой связи C N (0,147 нм). Частично двоесвязный характер пептидной связи делает невозможным своб. вращение заместителей вокруг нее. поэтому пептидная группировка является плоской и имеет обычно транс-конфигурацию (ф-ла I). T. обр., остов пептидной цепи представляет собой ряд жестких плоскостей с подвижным ("шарнирным") сочленением в месте, где расположены асимметрич. атомы С (в ф-ле I обозначены звездочкой).
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
.png)
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема
.png)
Это обусловливает следующие свойства:
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот трансориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также трансориентированы.
- Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
{69}
Белки (протеины)
Краткое описание:
Определение понятия
Белки (протеины, полипептиды) — это высокомолекулярные органические гетерополимеры, состоящие из цепочки остатков L-альфа-аминокислот, последовательно соединённых друг с другом пептидными связями.
В живых организмах состав и последовательность аминокислотнах остатков в белках определяются генетическим кодом ДНК. При биосинтезе белков в большинстве случаев используется 20 стандартных аминокислот, которые называют "белковыми аминокислотами".
Классификация
Белки подразделяются на две группы: 1. Протеины (простые белки) - состоят только из аминокислот и при гидролизе почти не образуют других продуктов. 2. Протеиды (сложные белки) - состоят из собственно белковой части, построенной из α-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой. При гидролизе протеиды кроме α-аминокислот образуют и другие вещества, например, фосфорную кислоту, глюкозу, гетероциклические соединения и т. д.
1. Протеины 1) Альбумины. Растворимы в воде, при нагревании свертываются. Осаждаются насыщенными растворами солей (не осаждаются насыщенным раствором хлорида натрия NaCl, но могут быть осаждены при насыщении раствора сульфатом аммония). Имеют сравнительно небольшую молекулярную массу. При гидролизе дают мало гликоколя. Входят в состав белка яйца, сыворотки крови, молока, а также ферментов и семян растений. 2) Глобулины. Нерастворимы в воде. Растворяются в разбавленных растворах солей и осаждаются концентрированными растворами солей. Свертываются при нагревании. Имеют большую молекулярную массу, чем альбумины. Входят в состав мышечных волокон (миозин), яйца, молока, крови, растительных семян (конопля, горох). 3) Проламины. Нерастворимы в воде. Растворяются в 60—80 %-ном спирте. Не свертываются при кипячении. Содержат много пролина. Входят в состав растительных белков (глиадин пшеницы, гордеин ячменя, зеин кукурузы). 4) Протамины. Сильные основания. Хорошо растворимы в воде, в разбавленных кислотах и щелочах. Не свёртываются при нагревании. Не содержат серы. Имеют простой аминокислотный состав (состоят преимущественно из диаминокислот) и низкую молекулярную массу. Входят в состав спермы и икры рыб, а также в состав сложных белков – нуклеопротеидов. 5) Гистоны. Менее сильные основания. Содержат значительное количество диаминокислот со свободными аминогруппами. Растворимы в воде и в разбавленных кислотах, но нерастворимы в разбавленных щелочах. Обычно представляют собой собственно белковые части сложных белков. В качестве примера можно назвать глобин – белок, входящий в состав сложного белка крови – гемоглобина. 6) Склеропротеины. Нерастворимы в воде, растворах солей, кислот и щелочей (они растворяются лишь при длительной обработке концентрированными кислотами и щелочами, причем с расщеплением молекул). Устойчивы к гидролизу. Характеризуются высоким содержанием серы. В животных организмах выполняют опорные и покровные функции; в растениях не встречаются. Представители: коллаген – белковое вещество костей, кожи, хрящей, соединительных тканей; эластин – белок стенок кровеносных сосудов, сухожилий; кератин - белок шерсти, волос, рогового вещества, ногтей, эпидермиса кожи; фиброин – белок шелка.
2. Протеиды 1) Нуклеопротеиды. Гидролизуются на простой белок (чаще всего гистоны или протамины) и нуклеиновые кислоты. Последние в свою очередь гидролизуются с образованием углевода, фосфорной кислоты, гетероциклического основания. Растворимы в щелочах и нерастворимы в кислотах. Входят в состав протоплазмы, клеточных ядер, вирусов. 2) Фосфопротеиды. Гидролизуются на простой белок и фосфорную кислоту. Слабые кислоты. Свертываются не при нагревании, а от действия кислот. К ним относятся казеин коровьего молока и вителлин – белок, входящий в состав желтка куриного яйца. 3) Гликопротеиды. Гидролизуются на простой белок и углевод. Нерастворимы в воде. Растворяются в разбавленных щелочах. Нейтральны. Не свертываются при нагревании. Входят в состав слизей. Представитель: муцин, входящий в состав слюны. 4) Хромопротеиды. Распадаются при гидролизе на простой белок и красящее вещество. Примером является гемоглобин крови; при гидролизе он расщепляется, образуя белок глобин и красящее вещество гем красного цвета. 5) Липопротеиды. Это соединения белка с липидами. Содержатся в протоплазме клеток, в сыворотке крови, в яичном желтке.
.
• РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
.gif)
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора.
{70}
Когда уплотнение карбонилсодержаших соединений протекает с образованием новых углерод-углеродных связей, атом водорода, входящий в метильную или метиленовую группу, соседнюю с карбонильной группой, связывается с атомом кислорода карбонильной группы второй молекулы альдегида или кетона. Например, конденсация уксусного альдегида может быть выражена следующим уравнением:
.gif)
Образующееся вещество, содержащее одновременно альдегидную группу и гидроксильную (алкогольную) группу, было названо альдолем, а конденсация этого типа называется альдольной конденсацией. Аналогичной конденсацией ацетона получается диацетоновый алкоголь:
.gif) Эти реакции конденсации всегда идут с участием атомов водорода, стоящих у углеродного атома, соседнего с карбонильной группой, т. е. в α-положении. Подвижность этих водородных атомов, способных отщепляться в виде протонов, обусловлена ослаблением их связи с атомом углерода в результате смещения электронного облака σ-связей по направлению к кислородному атому карбонильной группы. Это может быть изображено схемой
Эти реакции конденсации всегда идут с участием атомов водорода, стоящих у углеродного атома, соседнего с карбонильной группой, т. е. в α-положении. Подвижность этих водородных атомов, способных отщепляться в виде протонов, обусловлена ослаблением их связи с атомом углерода в результате смещения электронного облака σ-связей по направлению к кислородному атому карбонильной группы. Это может быть изображено схемой
.gif)
Роль щелочных катализаторов состоит в том, что гидроксильные ионы способствуют отрыву протона, например:
.gif)
При конденсации ацетона или метилэтилкетона с формальдегидом, легко протекающей под влиянием небольших количеств едких щелочей, образуются бутанол-1-он-3 (β-ацетоэтиловый спирт) и 2-метилбутанол-1-он-3 (β-ацетопропиловый спирт):
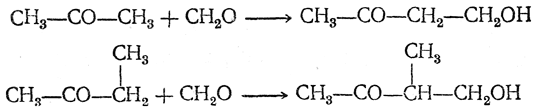
С избытком формальдегида реакция может идти и дальше, если у атома углерода, находящегося по соседству с карбонильной группой, имеется еще один атом водорода. Например:
.gif)
Альдегиды могут также вступать в реакции конденсации с кетонами и с другими веществами, принадлежащими как к жирному, так и особенно к ароматическому ряду, — с углеводородами, аминами, нитросоединениями, кислотами, сложными эфирами и пр., например:
.gif)
{71}
Карбоновыми кислотами называются соединения, содержащие функциональную карбоксильную группу – С(О) ОН
Карбоксильная группа содержит в себе карбонильную и гидроксильную группы. Вследствие близкого расположения они оказывают сильное влияние друг на друга.
Гидроксогруппа кислот легче отщепляет протон водорода, чем гидроксогруппа спиртов. Причина усиления кислотности – полярная карбонильная группа. Карбонильный атом углерода, несущий положительный заряд, стремится погасить дефицит электронов, притягивая электронные пары не только связей R – C и С = О, но и свободные электронные пары кислорода гидроксильной группы. Поэтому гидроксильный кислород сильнее оттягивает электронную пару связи О–Н, усиливая положительный заряд на атоме водорода.
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноoсновные (одна группа – СООН), дикарбоновые, или двухосновные (две группы — СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими, алициклическими или ароматическими. Для названия карбоновых кислот пользуются тривиальной номенклатурой и международной номенклатурой ИЮПАК. По международной номенклатуре названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания «-овая кислота». Приведем формулы некоторых кислот, и назовем их по тривиальной и международной номенклатурам:
В непредельных карбоновых кислотах имеет место пространственная геометрическая изомерия (подобно этиленовым углеводородам). Например, цис-изомер – малеиновая кислота и транс-изомер – фумаровая кислота.
Методы получения карбоновых кислот.
1. Общий способ получения карбоновых кислот – окисление альдегидов и первичных спиртов.
СН3 – СН2ОН → СН3 – СОН → СН3 – СООН
2. Гидролиз сложных эфиров.
СН3 – СООС2Н5 + Н2О ↔ СН3 – СООН + С2Н5ОН
3. Из моногалогенпроизводных при действии цианида калия и последующим разложением полупродукта водой.
С2Н5СI + КСN → КСI + С2Н5 – С ≡ N
С2Н5 – С ≡ N + 2Н2О → СН3 – СН2 – СООН + NН3
4. Гидролизом трехгалогенпроизводных углеводородов.
СН3 – ССI3 + 3NаОН → СН3 – СООН + 3NаСI + Н2О
5. Отдельные кислоты получают специфическими методами. Муравьиную кислоту получают из оксида углерода (II) и гидроксида натрия с последующим разложением формиата натрия сильной кислотой.
200оС, Р Н2SO4
NаОН + СО → НСООNа → НСООН
6. Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
С4Н10 + 5О2 → 4СН3 – СООН + 2Н2О
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обладают кислыми свойствами, окрашивая лакмус в красный цвет, что обусловлено диссоциацией.
СН3 – СООН ↔ СН3 – СОО- + Н+
Карбоновые кислоты слабее неорганических, наиболее сильной из них является муравьиная.
2. Водород карбоксила замещается на металлы при реакциях с активными металлами, основными оксидами, гидроксидами и солями слабых кислот.
2СН3 – СООН + Ва → (СН3 – СОО)2Ва + Н2↑
2СН3 – СООН + СаО → (СН3 – СОО)2Са + Н2О
СН3 – СООН + КОН → СН3 – СООК + Н2О
СН3 – СООН + КНСО3 → СН3 – СООК + СО2 + Н2О
3. При взаимодействии с треххлористым фосфором (а), пятихлористым фосфором (б) и хлористым тионилом (в) образуются хлорангидриды кислот:
а) 3СН3 – СН2 – СООН + РСI3 → 3СН3 – СН2 – СОСI + Н3РО3
б) СН3 – СООН + РСl5 → CH3 – COCl + POCl3 + HCl
в) CH3 – COOH + SOCl2 → CH3 – COCl + SO2 + HCl
4. Замещение гидроксила на остаток кислоты приводит к образованию ангидрида.
СН3 – СООН + НООС – СН3 → СН3 – С(О) – O — (О)С – СН3 + Н2О
5. Замещение гидроксила в карбоксильной группе на остаток спирта приводит к получению сложного эфира.
НСООН + СН3ОН ↔ НСООСН3 + Н2О
6. Атомы водорода в радикальной части могут замещаться на галогены.
Н3С – СООН + 3СI2 → СI3С – СООН + 3НСI
7. Присоединение водорода. Получается альдегид, затем спирт
НСООН + Н2 → НСОН + Н2О, НСОН + Н2 → СН3ОН
8. Присоединение воды с образованием ортогидратов.
СН3 – СООН + Н2О → СН3 – С(ОН)3
Это был урок по химии 40 – Карбоновые кислоты. Методы получения и свойства.
Поверхностно активные вещества.
Поверхностно-активные вещества (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения. Данное свойство этих веществ активно используется при изготовлении очистителей, моющих средств, косметики.
Синтетические поверхностно-активные вещества (ПАВ) делятся на 4 класса:
- анионные ПАВ – соединения, которые в водных растворах диссоциируют с образованием анионов, обусловливающих поверхностную активность. Среди них наибольшее значение имеют алкилбензосульфонат, сульфаты и сульфоэфиры жирных кислот;
- катионные ПАВ – соединения, которые в водном растворе диссоциируют с образованием катионов, определяющих поверхностную активность. Среди катионных ПАВ наибольшее значение имеют четвертичные аммониевые соединения, имидазалины, жирные амины.
- амфотерные (амфолитные) ПАВ – соединения, которые в водных растворах в зависимости от значения рН среды по разному ионизируются и действуют - в кислом растворе проявляют свойства катионных ПАВ, а в щелочном растворе – анионных ПАВ. Основные амфотерные ПАВ это алкилбетаины, алкиламинокарбоновые кислоты, производные алкил имидазолинов, алкиламиноалкансульфонаты.
- неионогенные ПАВ – соединения, которые в полном соответствии названию, растворяются в воде не ионизируясь. Растворимость неионогенных ПАВ в воде обуславливается присутствием функциональных групп. Как правило, в водном растворе они образуют нитраты, вследствие возникновения водородных связей между молекулами воды и атомами кислорода полиэтиленгликолевой части молекулы ПАВ. К неионогенным ПАВ относятся: полигликолевые эфиры жирных спиртов и кислот, полигликолевые эфиры амидов жирных кислот, ацилированные или алкилированные полигликолевые эфиры алкиламидов.
Синтетические моющие средства
Основными видами ПАВ, используемых в составе СМС, являются алкилбензосульфонаты с линейной алкильной цепью (ЛАБС) и производные спиртов С12-С15 (этоксилаты, сульфаты, этоксисульфаты спиртов). ЛАБС и сульфаты спиртов, наряду с мылом, относятся к анионным ПАВ, этоксилаты спиртов – к неионным ПАВ.
Вторым важным видом ПАВ для СМС являются неионные ПАВ, получаемые оксиэтилированием высших жирных спиртов или алкилфенолов.
Неионные ПАВ, как правило превосходят анионные ПАВ как по чистящему, так и обезжиривающему действию и в зависимости от профиля использования эмульгируют больше или меньше масла и жира. Также неионные ПАВ, благодаря вариабильности их основы и степени оксиэтилирования или пропоксилирования можно идеальным образом подогнать под конкретную задачу.
Косметика
ПАВ широко используется в косметике. - Это шампуни, жидкое мыло, ополаскиватели, краска для волос и бальзамы для ухода за волосами после мытья. Павы это и косметические крема для лица, тела, рук в т. ч. лечебно-профилактического действия.
Амфотерные ПАВ в сочетании с анионными ПАВ улучшают пенообразующую способность и повышают безвредность рецептур, а при соединении с катионными полимерами усиливают положительное воздействие силиконов и полимеров на волосы и кожу. Эти производные получают из природного сырья, поэтому они являются достаточно дорогостоящими компонентами. Чаще всего используют производные бетаина (кокаминопропил бетаин)
Наиболее действенными антистатиками являются катионные ПАВ — четвертичные аммониевые соединения, хотя существуют проблемы несовместимости с анионными ПАВ. Однако, в смеси с неионными и амфотерными веществами удается достигнуть желаемого эффекта и сохранить стабильность готового продукта.

