{60}
Мочевина, получение свойства применения
Мочеви́на (карбамид) — химическое соединение, диамид угольной кислоты. Белые кристаллы, растворимые в полярных растворителях (воде, этаноле, жидком аммиаке).
физические свойства
Бесцветные кристаллы без запаха, кристаллическая решетка тетрагональная (а = 0,566 нм, b= 0,4712 нм, c = 2); претерпевает полиморфные превращения.
Мочевина хорошо растворима в полярных растворителях (вода, жидкие аммиак и сернистый ангидрид), при снижении полярности растворителя растворимость падает, нерастворима в неполярных растворителях (алканы, хлороформ).
Растворимость (г в 100 г р-рителя):
· в воде — 67 (0 °C), 84 (10 °C), 104,7 (20 °C), 135,3 (30 °C), 165,3 (40 °C), 205 (50 °C), 246 (60 °C), 400 (80 °C), 733 (100 °C);
· в жидком аммиаке — 49,2 (20 °C, 709 кПа), 90 (100 °C, 1267 кПа);
· в метаноле — 22 (20 °C);
· в этаноле — 5,4 (20 °C);
· в изопропаноле — 2,6 (20 °C);
· в изобутаноле — 6,2 (20 °C);
· в этилацетате — 0,08 (25 °C);
· в хлороформе — ~0 (не растворяется).
Нуклеофильность
Реакционная способность мочевины типична для амидов: оба атома азота являются нуклеофилами, то есть мочевина образует соли с сильными кислотами, нитруется с образованием N-нитромочевины, галогенируется с образованием N-галогенпроизводных. Мочевина алкилируется, образуя соответствующие N-алкилмочевины RNHCONH2, взаимодействует с альдегидами, образуя производные 1-аминоспиртов RC(OH)NHCONH2,
В жёстких условиях мочевина ацилируется хлорангидридами карбоновых кислот с образованием уреидов (N-ацилмочевин):
.png)
Взаимодействие мочевины с дикарбоновыми кислотами и их производными (сложными эфирами и т. п.) ведёт к образованию циклических уреидов и широко используется в синтезе гетероциклических соединений; так, взаимодействие с щавелевой кислотой ведёт к парабановой кислоте, а реакция с эфирами замещённых малоновых кислот — к 1,3,5-триоксипиримидинам — производным барбитуровой кислоты, широко применявшимся в качестве снотворных препаратов:
.png)
В водном растворе мочевина гидролизуется с образованием аммиака и углекислого газа, что обуславливает ее применения в качестве минерального удобрения.
Электрофильность[править | править исходный текст]
Карбонильный атом углерода в мочевине слабоэлектрофилен, однако спирты способны вытеснять из мочевины аммиак, образуя уретаны:
.png)
К этому же классу реакций относится взаимодействие мочевины с аминами, ведущее к образованию алкилмочевин:
.png)
и реакция с гидразином с образованием семикарбазида:
.png)
образование при нагревании биурета H2NCONHCONH2.
Комплексообразование
В промышленности мочевина синтезируется по реакции Базарова из аммиака и углекислого газа
.png)
По этой причине производства мочевины совмещают с аммиачными производствами.
Мочевина является крупнотоннажным продуктом, используемым, в основном, как азотное удобрение (содержание азота 46 %) и выпускается, в этом качестве, в устойчивом к слёживанию гранулированном виде.
Другим важным промышленным применением мочевины является синтез мочевино-альдегидных (в первую очередь мочевино-формальдегидных) смол, широко использующихся в качестве адгезивов в производстве древесно-волокнистых плит (ДВП) и мебельном производстве. Производные мочевины — эффективные гербициды.
Мочевина также применяется для очистки дымовых газов тепловых электростанций, котельных, мусоросжигательных заводов, двигателей внутреннего сгорания и т. п. от оксидов азота:
{61}
Получение и свойства ацетоуксусного эфира..
Ацетоуксусный эфир (этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
.png)
Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
CH3(HO)C=CHCOOC2H5 + ROCl CH3(ROO)C=CHCOOC2H5 + HCl
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
CH3(HO)C=CHCOOC2H5 + PCl5 CH3ClC=CHCOOC2H5 + POCl3 + HCl
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
CH3COCH2COOC2H5 + EtONa CH3COCH-COOC2H5 Na+ + EtOH
CH3COCH-COOC2H5 Na+ + RHal CH3COCHRCOOC2H5 + NaHal
{62}
.Классификация и номенклатура аминокислот. Аминокислоты, выделенные из белков
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминныегруппы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Классификация
Аминокислоты классифицируют по структурным признакам.
1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные.
3По характеру углеводородного радикала различают алифатические(жирные),ароматические,серосодержащие и гетероциклическиеаминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
По радикалу
Неполярные: аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
Полярные незаряженные (заряды скомпенсированы) при pH=7: глицин, серин, треонин, цистеин, аспарагин, глутамин,тирозин
· Полярные заряженные отрицательно при pH=7: аспартат, глутамат
· Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин
По функциональным группам
· Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
· Оксимоноаминокарбоновые: серин, треонин
· Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
· Амиды моноаминодикарбоновых: аспарагин, глутамин
· Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
· Серосодержащие: цистеин, метионин
· Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
· Гетероциклические: триптофан, гистидин, пролин
· Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
· Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
· Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
НОМЕНКЛАТУРА
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
|
Аминокислота |
Сокращённое обозначение |
Строение радикала ( R )
|
|
Глицин |
Gly (Гли) |
H - |
|
Аланин |
Ala (Ала) |
CH3 - |
|
Валин |
Val (Вал) |
(CH3)2CH - |
|
Лейцин |
Leu (Лей) |
(CH3)2CH – CH2 - |
|
Серин |
Ser (Сер) |
OH- CH2 - |
|
Тирозин |
Tyr (Тир) |
HO – C6H4 – CH2 - |
|
Аспарагиновая кислота |
Asp (Асп) |
HOOC – CH2 - |
|
Глутаминовая кислота |
Glu (Глу) |
HOOC – CH2 – CH2 - |
|
Цистеин |
Cys (Цис) |
HS – CH2 - |
|
Аспарагин |
Asn (Асн) |
O = C – CH2 – │ NH2 |
|
Лизин |
Lys (Лиз) |
NH2 – CH2- CH2 – CH2 - |
|
Фенилаланин |
Phen (Фен) |
C6H5 – CH2 - |
Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы NH2 – триамино- и т.д.Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
{65}
Реакции аминокислот по аминогруппе
Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a -,b -, g - и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
.gif)
Реакция с формальдегидом:
.jpg)
Эта реакция лежит в основе количественного определения a-аминокислот методом формольного титрования щелочью (метод Серенсена).
Реакция ацилирования:
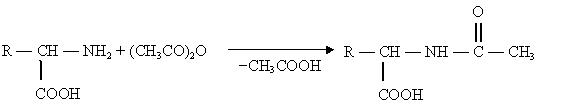
Реакция используется для «защиты» аминогрупп при пептидном синтезе.
Реакция с азотистой кислотой:
.jpg)
По объему выделившегося азота определяют количество аминогрупп в природных аминосодержащих соединениях (метод Ван-Слайка).

