Ідеа́льний газ (рос. идеальный газ; англ. ideal gas, нім. ideales Gas n) — це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями до ідеального газу є реальні розріджені гази, тиск в яких не перевищує 200 атмосфер і які перебувають при не дуже низькій температурі, оскільки за таких умов відстань між молекулами набагато перевищує їх розміри.
Розрізняють три типи ідеального газу:
- Класичний ідеальний газ або газ Максвелла-Больцмана.
- Ідеальний квантовий газ Бозе (складається з бозонів). Див. статистика Бозе-Ейнштейна.
- Ідеальний квантовий газ Фермі (складається з ферміонів).
Термодинаміка класичного ідеального газу[ред. • ред. код]
Термодинамічні властивості ідеального газу можна описати такими двома рівняннями:
Стан класичного ідеального газу описується рівнянням стану ідеального газу:
Внутрішня енергія ідеального газу описується наступним рівнянням:
Зако́н Бо́йля — Маріо́тта — закон ідеальних газів, згідно з яким добуток тиску на об'єм незмінної маси такого газу при сталій температурі є величина стала:

.
У певних межах справедливий для розріджених реальних газів, тобто для природних і нафтових вуглеводневих газів за нормальних (чи стандартних) умов. Тоді його записують так: p0 V0 = pV, де індекс нуль означає ці умови.
Закон відкрив і опублікував у 1662 році Роберт Бойль. Едм Маріотт опублікував такий же закон в 1676 році на основі незалежних досліджень.
На термодинамічній діаграмі p — V ізотермічний процес зображаєтсья кривою, що називаєься ізотермою.
Зако́н Гей-Люсса́ка — назва двох законів, що описують властивості газів.
1) Закон теплового розширення газів: при сталому тискові залежність об'єму Vt даної маси газу від температури описується формулою:
Vt/T = const
або
Vt=V0(1+ αt),
де V0 — об'єм газу при даному тискові і при температурі 273,15 К, t — температура (емпірична) за шкалою Цельсія, Т — термодинамічна температура, α — коефіцієнт об'ємного розширення газу (для інертних газів, водню і кисню, та дорівнює коефіцієнту об'ємного розширення ідеального газу α = 1/(273,15 К)).
2) Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликі прості числа. Наприклад, при взаємодії одного об'єму водню з одним об'ємом хлору утворюється два об'єми хлористого водню.
Закон носить ім'я французького вченого Жозефа-Луї Гей-Люссака.
Зако́н Ша́рля — назва закону, що описує властивості газів. Описує ізохорний процес в ідеальному газі.
Закон теплового розширення газів: при сталому об'ємі залежність тиску Р даної маси газу від температури описується формулою:
 ,
,
де Т — термодинамічна температура; Р — тиск газу.
 , чи
, чи  ,
,
де 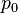 — тиск газу при температурі
— тиск газу при температурі  ,
,
 — термічний коефіцієнт тиску, що характуризує відносне збільшення тиску газу при нагріванні його на один градус.
— термічний коефіцієнт тиску, що характуризує відносне збільшення тиску газу при нагріванні його на один градус.
Закон носить ім'я французького вченого Жака Шарля.

