Адиабати́ческий — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем, если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок  совершать работу
совершать работу

где F — сила, с которой газ действует на поршень. Перепишем уравнение:
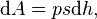
где s — площадь поршня. Тогда работа будет равна

где 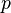 — давление газа,
— давление газа,  — малое приращение объёма.
— малое приращение объёма.
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости  , предельными частными явлениями политропного процесса являются изотермический процесс (
, предельными частными явлениями политропного процесса являются изотермический процесс ( ) и адиабатный процесс (
) и адиабатный процесс ( ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными (удельные теплоёмкости идеального газа при постоянном объёме и постоянном давлении соответственно равны  и (
и ( и не меняются при изменении термодинамических параметров).
и не меняются при изменении термодинамических параметров).
Показатель политропы
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:

где р — давление, V — объем газа, n — «показатель политропы».
 . Здесь
. Здесь  — теплоёмкость газа в данном процессе,
— теплоёмкость газа в данном процессе,  и
и 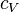 — теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
— теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
- Изотермический процесс:
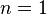 , так как
, так как  , значит, по закону Бойля — Мариотта
, значит, по закону Бойля — Мариотта  , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
- Изобарный процесс:
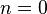 , так как
, так как  , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
- Адиабатный процесс:
 (здесь
(здесь 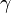 — показатель адиабаты), это следует из уравнения Пуассона.
— показатель адиабаты), это следует из уравнения Пуассона.
- Изохорный процесс:
 , так как
, так как  , и в процессе
, и в процессе  , а из уравнения политропы следует, что
, а из уравнения политропы следует, что  , то есть, что
, то есть, что  , то есть
, то есть  , а это возможно, только если
, а это возможно, только если  является бесконечным.
является бесконечным.


