Кристаллизация — один из распространенных и наиболее эффективных методов получения вещества в чистом виде.Кристаллизацией называют процесс выделения твердой фазы в еиде кристаллов из растворов и расплавов. Кристаллы представляют собой твердые тела различной геометрической формы, ограниченные плоскими гранями. Кристаллы, содержащие молекулы воды, называют кристаллогидратами.
В пищевой технологии выделение твердой фазы из растворов или расплавов в виде кристаллического продукта является завершающей стадией технологического процесса получения сахарозы, глюкозы, соли и других кристаллических продуктов.
Кристаллизацию, как правило, проводят из водных растворов. При понижении температуры или удалении части растворителя уменьшается растворимость твердого вещества. Раствор становится пересыщенным, и твердое вещество выпадает из раствора в осадок.Производственный технологический процесс, кристаллизации состоит из нескольких стадий: кристаллизация, отделение кристаллов от маточных раствором, перекристаллизация (если требуется), промывка и сушка кристаллов.
СТАТИКА ПРОЦЕССА
Твердые вещества в зависимости от того, как меняется кх растворимость с повышением температуры, могут обладать «положительной» или «отрицательной» растворимостью. Если растворимость увеличивается с повышением температуры, такие вещества обладают «положительной» растворимостью, если снижается, говорят об «отрицательной» растворимости вещества в данном растворителе.
Раствор, находящийся в равновесии с твердой фазой при данной температуре, называют насыщенным. В таких растворах между твердым веществом и раствором имеет место динамическое равновесие, характеризующееся тем, что в единицу времени количество частиц, растворяющихся из кристаллов и переходящих в раствор, равно числу частиц, кристаллизующихся в растворе и переходящих в твердую фазу-
Пересыщенными называют такие растворы, в которых концентрация растворенного вещества больше его растворимости. Пересыщенные растворы неустойчивы, легко переходят в насыщенные растворы. При таком переходе из пересыщенных растворов выпадает твердая фаза.
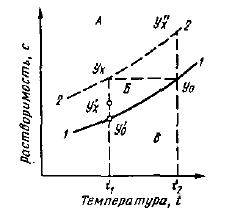

Поведение растворов с изменением их температуры характеризуют диаграммы состояния растворов (рис. 23.1), Растворы при концентрациях, соответствующих лабильной области, кристаллизуются очень быстро,а растворы при концентрациях, соответствующих метастабильной области, кристаллизуются; сравнительно медленно в зависимости от температуры раствора, скорости отвода теплоты или скорости испарения растворителя, перемешивания и других факторов.Для растворов веществ, зависимость которых от температуры неярко выражена, переход в область пересыщенных растворов происходит только при очень значительном снижении температуры. При изменении температуры от t2 до (i количество выпавшей из раствора твердой фазы невелико и пропорционально изменению кон-центрации раствора ух-~ у$. Пересыщение раствора может быть достигнуто и при постоянной температуре f, путем удаления части растворителя. При этом из раствора выпадает часть твердой фазы, пропорциональная разности концентраций yj—y0. Следовательно, кристаллизацию таких растворов можно провести как снижением температуры раствора, так и путем удаления част растворителя.Для веществ с ярко выраженной зависимостью растворимости от температуры оптимальным методом кристаллизации является снижение температуры.Если расгворимость вещества не изменяется с увеличением тем пературы, то кристаллизация осуществляется путем удаления растворителя. КИНЕТИКА И УСЛОВИЯ КРИСТАЛЛИЗАЦИИПереход вещества из раствора в твердую фазу осуществляется путем диффузии растворенного вещества через пограничный слой, окружающий поверхность кристалла. Скорость процесса кристаллизации может определяться скоростью диффузии растворенного вещества через пограничный слой либо скоростью слияния вещества с телом кристалла либо зависеть от обеих стадий одновременно.Рассмотрим процесс кристаллизации сахарозы. В процессе роста кристаллы окружены пограничным слоем пересыщенного межкристального раствора толщиной 6. Избыток молекул сахарозы из этого слоя пересыщенного раствора быстро выделяется на поверхности кристаллов, и раствор становится насыщенным с концентрацией сахарозы уы. На некотором расстоянии от граней кристаллов в окружающем растворе сохраняется пересыщение с концентрацией сахарозы уа.Вследствие разности концентраций у„—ун сахароза диффундирует через пограничный слой раствора. Приблизившись к граням кристаллов, молекулы сахарозы переходят в кристаллическую решетку— происходит фазовый переход. Таким образом, скорость роста кристаллов обусловлена скоростью диффузии сахарозы и скоростью фазового перехода ка границе раздела фаз. Если скорость фазового перехода намного выше скорости диффузии сахарозы, то лимитирующей стадией процесса кристаллизации сахарозы является ее диффузия. Скорость роста кристаллов сахарозы можно выразить уравнением, аналогичным : 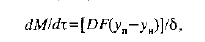 Уравнение применимо для общей качественной оценки процесса роста кристаллов сахарозы в чистых и технических растворах.Основными факторами, определяющими скорость кристаллизации, являются степень пересыщения раствора, температура, образование центров кристаллизации, интенсивность перемешивания, наличие примесей в растворе.Процесс кристаллизации состоит из двух стаций: оОразование центров кристаллизации и рост кристаллов.Оптимизация процесса кристаллизации заключается в устойчивом регулируемом кристаллообразовании, росте кристаллов, регулируемом отводе или подводе теплоты в системе. Количество и размер зародышей кристаллов зависят от скорости достижения пересыщения раствора и его температуры.
Уравнение применимо для общей качественной оценки процесса роста кристаллов сахарозы в чистых и технических растворах.Основными факторами, определяющими скорость кристаллизации, являются степень пересыщения раствора, температура, образование центров кристаллизации, интенсивность перемешивания, наличие примесей в растворе.Процесс кристаллизации состоит из двух стаций: оОразование центров кристаллизации и рост кристаллов.Оптимизация процесса кристаллизации заключается в устойчивом регулируемом кристаллообразовании, росте кристаллов, регулируемом отводе или подводе теплоты в системе. Количество и размер зародышей кристаллов зависят от скорости достижения пересыщения раствора и его температуры.

