Закон Бойля-Мариотта При увеличении объема газа его давление во столько же раз уменьшается и наоборот
Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году. Описывает поведение газа в изотермическом процессе. Закон является следствием уравнения Клапейрона[1].
В математической форме это утверждение записывается в виде формулы

где 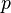 — давление газа;
— давление газа; 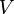 — объём газа, а
— объём газа, а 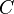 — постоянная в оговоренных условиях величина. В общем случае значение
— постоянная в оговоренных условиях величина. В общем случае значение 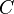 определяется химической природой, массой и температурой газа.
определяется химической природой, массой и температурой газа.
Закон Шарля При увеличении объема газа его абсолютная температура во столько же раз увеличивается и наоборот.
Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 году.
Формулировка закона Шарля следующая:
Давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
Закон Гей-Люссака для данной массы данного газа при постоянном давлении отношение объема к абсолютной температуре есть величина постоянная
Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении, названный в честь французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году.
Изобарический закон, открытый Гей-Люссаком в 1802 году утверждает, что при постоянном давлении, объём постоянной массы газа пропорционален абсолютной температуре. Математически закон выражается следующим образом:

или

где 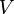 — объём газа,
— объём газа,  — температура.
— температура.
Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме:
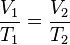
или
 .
.
Закон Дальтона давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов.
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
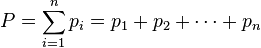
Закон Паскаля давление, производимое внешними силами на поверхность жидкости или газа, передается одинаково по всем направлениям.
Закон Паскаля формулируется так:
Возмущение давления, производимое на покоящуюся несжимаемую жидкость, передается в любую точку жидкости одинаково по всем направлениям.
Закон Паскаля описывается формулой давления:
,
Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона:
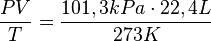 .
.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.

