Пятичленные гетероциклы с одним гетероатомом.
В эту группу входят пятичленные ароматические гетероцыклы: пиррол, фуран, тиофен.
Пиррол
Пиррол С4H4NН – пятичленный гетероцикл с одним атомом азота.

Бесцветная жидкость с температурой кипения 130С, плохо растворимая в воде, на воздухе быстро окисляется и темнеет.
Химические свойства.
1) Основные свойства
Пиррол является чрезвычайно слабым основанием. Протонирование по атому азота означает нарушение стабильной p-системы и потерю ароматичности. В действительности присоединение протона происходит по атомам углерода пиррольного кольца, преимущественно по a-положению. Образующаяся таким образом сопряженная кислота атакует молекулу пиррола, в результате чего происходит полимеризация.
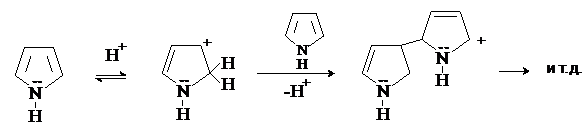
Фуран также полимеризуется под действием кислот. Поэтому пиррол и фуран называют ацидофобными соединениями. Введение электроноакцепторных групп снижает ацидофобность. Например, фурфурол и пирослизевая кислота устойчивы к действию кислот.
Тиофен, в отличие от пиррола и фурана, неацидофобен.
2) Кислотные свойства пиррола
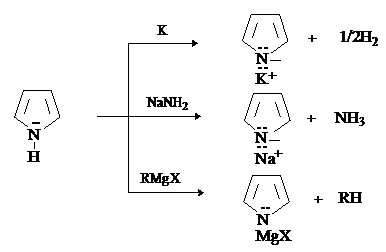
Пиррол является слабой NH-кислотой (рКа=17,5). По кислотности он превосходит амины и близок к спиртам. Соли пиррола получают взаимодействием пиррола с металлами, амидами металлов, металлоорганическим соединениями.
3) Реакции электрофильного замещения
Пиррол, фуран и тиофен являются электронодонорными соединениями и проявляют высокую реакционную способность по отношению кэлектрофилам. Реакционная способность в реакциях электрофильного замещения возрастает в ряду бензол<тиофен<фуран<пиррол.
Электрофильное замещение идет преимущественно в положение 2, что вытекает из сравнения стабильности s-коплексов, ведущих к продуктам 2- и 3-замещения.
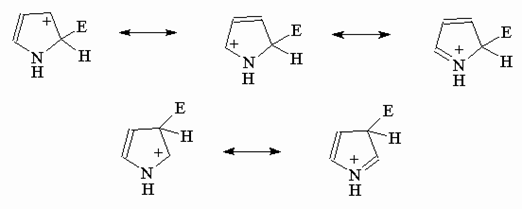
Как видно из приведенной выше для пиррола схемы, в s-коплексе (I) достигается более эффективная делокализации положительного заряда (три резонансные структуры), чем в s-коплексе (II) (две резонансные структуры).
Взаимодействие гетероциклов с электрофилами может привести и к образованию продуктов присоединения (см. кислотные свойства). Склонность к такого рода превращениям убывает в ряду фуран>пиррол>тиофен, что соответствует степени стабилизации их ароматических систем.
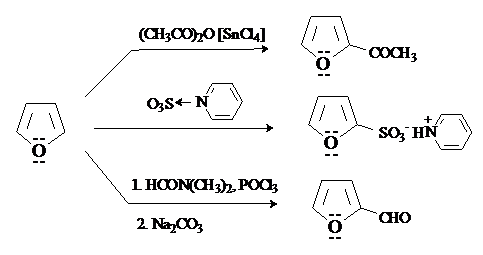
Пиррол по реакционной способности по отношению к электрофилам напоминает активированные ароматические субстраты (фенол или ароматические амины). Из-за ацидифобности пиррола при проведении реакций электрофильного замещения необходимо избегать сильно кислых сред. Основные SE-реакции пиррола суммированы на схеме.
Нитрование и сульфирование пиррола возможны только в том случае, если исключена сильнокислая среда. Нитрование проводят действиемацетилнитрата при низких температурах. Для сульфирование используют связанный в комплекс SO3, например, пиридинсульфотриоксид. Галогенирование протекает без катализатора и дает тетрагалогенпирролы.
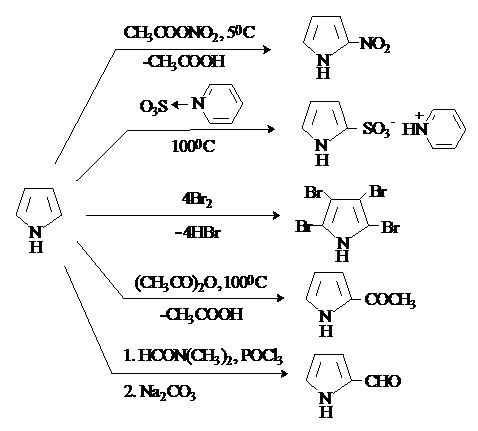
Пиррол ацилируется ангидридами кислот в отсутствие катализатора. Как активированный субстрат пиррол вступает в реакцииформилирования. Наиболее общим методом формилирования пирролов является реакция Вильсмейера-Хаака.
Фуран, как и пиррол, ацидофобен, поэтому реакции с электрофилами проводят в отсутствие сильных кислот. Фуран ацилируется ангидридами кислот в присутствии мягких кислот Льюиса, сульфируется пиридинсульфотриоксидом, формилируется по реакции Вильсмейера-Хаака. Фуран реагирует более селективно, чем пиррол. Во всех случаях образуются исключительно продукты замещения по положению 2.
Фуран в большей степени, чем пиррол, склонен к образованию с электрофилами продуктов не замещения, а присоединения. Даже реакции, результатом которых является замещение, могут происходить через промежуточное образование продуктов присоединения (по механизму присоединения-отщепления). При нитровании фурана ацетилнитратом можно выделить продукт 2,5-присоединения, который под действием пиридина (Py), подвергается элиминированию с образованием в конечном итоге продукта замещения.
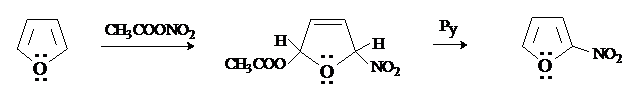
Тиофен, в отличие от пиррола и фурана, неацидофобен, поэтому реакции электрофильного замещения можно проводить с обычнымиэлектрофильными агентами, в том числе с использованием водных растворов минеральных кислот или в присутствии кислот Льюиса. Реакцииэлектрофильного замещения превалируют над процессами присоединения.

4) Реакции присоединения
Гидрирование.
Пиррол, фуран и тиофен присоединяют водород в условиях каталитического гидрирования с образованием тетрагидропроизводных.
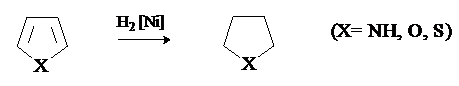
Труднее других гидрируется тиофен, который отравляет катализатор. Особенностью химии тиофена является восстановительнаядесульфуризация, которая используется в синтетических целях для получения соединений, трудно доступных другими методами.
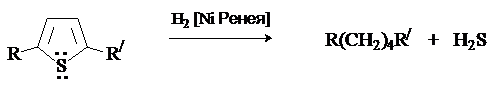
Пятичленные гетоциклы с двумя и больше гетероатомами.
При присутствии нескольких гетероатомов в пятичленном цикле с сопряженными двойными связями электронная плотность в кольце распределена неравномерно, это отображается на химических свойствах этих соединений.
Пятичленные гетероциклы сдвумя гетероатомами более стабильны; для них характерная меньшая активность в реакциях электрофильного замещения сравнительно с пятичленными гетероциклами и одним гетероаатомом.
Имидазол.

Имидазол (т. кипения 256°С) это пятичленный гетероцикл с двумя атомами азота, которые находятся в 1-ом и 3-ем положениях кольца.
Один с этих атомов аналогичный атому азота в пирроле и ответственный за слабокислотные свойства имидазола, другой похожий на пиридиновый атом азота и отвечает за слабоосновные свойства имидазола. Таким образом имидазол амфотерное соединение, образует соли с сильными кислотами и щелочными металлами.
Электрофильное замещение в кольце имидазола протекает по положениям 4 или 5, в которых электронная плотность намного больше, чем в положении 2. Атомы азота в молекуле имидазола равноценны, благодаря равновесию:

Наличие второго атома азота в кольце значительно понижает в нем электронную плотность, что стабилизирует молекулу в целом. Имидазол не боится кислой среды, а электрофильное замещение протекает значительно труднее, чем в случае с пирролом. Как слабая кислота, имидазол образует металлопроизводные с натрием или реактивами Гриньяра, подобно пирролу.
Алкилирование и ацилирование по атому азота.
При нагревании имидазола с алкилирующими агентам (алкилгалогенидами или алкилсульфатами) 1-алкилимидазолы получаются с невысоким выходом, так как побочно образуются имидазолиевые соли.

Если алкилированию подвергать анион имидазола, полученный предварительно в присутствии основания (щелочи или алкоголята), то выходы 1-алкилимидазолов существенно повышаются.
Действие на имидазол галогенангидридов или ангидридов кислот приводит к образованию высокореакционноспособных N-ацильных производных.

Замещение по атомам углерода.
По отношению к электрофильным реагентам имидазол занимает промежуточное положение между пиридином и реакционноспособными пятичленными гетероциклами с одним гетероатомом (пирролом, фураном и тиофеном). По легкости вступать в реакции нитрования и сульфирования имидазол уступает и бензолу, так как в сильнокислых средах электрофилом атакуется не нейтральная молекула, а катион имидазолия.

В щелочной среде имидазолы со свободной NH-группой вступают в реакцию азосочетания:

С диазотированной сульфаниловой кислотой образуются продукты, окрашенные в цвета от желтого до красного, обнаружить которые можно в количестве микрограммов. Это тест Паули на имидазолы.
Галогенирование имидазола в нейтральной среде, когда молекула неионизирована, протекает очень легко. Бромирование на холоду не останавливается на стадии монозамещения, а приводит к образованию тризамещенного продукта:

Имидазол обладает высокой устойчивостью к большинству окислителей и восстановителей. Но при действии пероксидов цикл размыкается с образованием оксамида H2NCOCONH2.

