Оксид серы (VI). SO3 — ангидрид серной кислоты — вещество с tпл= 16,8 °С и tкип= 44,8 °С. Оксид серы (VI), или триоксид серы, — это бесцветная жидкость, затвердевающая при температуре ниже 17° С в твердую кристаллическую массу. Оксид серы (VI) обладает всеми свойствами кислотных оксидов. Он является промежуточным продуктом производства серной кислоты.
Оксид серы (VI) получают окислением SO2 кислородом только в присутствии катализатора:

Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3 (т. е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Молекула SO3 имеет форму треугольника, в центре которого находится атом серы:

Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил все шесть внешних электронов.
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt или NaVO3 или оксид железа(III) Fe2O3):
Можно получить термическим разложением сульфатов:
![\mathsf{Fe_2(SO_4)_3 \xrightarrow[]{^ot} Fe_2O_3 + 3SO_3}](http://upload.wikimedia.org/math/2/f/a/2fa0e8022faf414c3cf46692bfafed3b.png)
или взаимодействием SO2 с озоном:

Для окисления SO2 используют также NO2:

Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
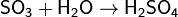
Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:

и оксидами:

SO3 растворяется в 100%-й серной кислоте, образуя олеум.
'2'. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:




