Современные квантово-механические представления о строении электронной оболочки атома исходят из того, что движение электрона в атоме нельзя описать определенной траекторией. Можно рассматривать лишь некоторый объем пространства. В котором находится электрон. Поскольку электрон обладает одновременно свойствами частицы и волны, то подходом к объяснению строения электронной оболочки может быть как корпускулярная, так и волновая теория; обе они приводят к одинаковому наглядному представлению, сформулированному как орбитальная модель атома. О наличии волновых свойств электрона первым высказался французский учёный Л. де Бройль. Уравнение де Бройля: =h/mV. Если электрон обладает волновыми свойствами, то пучок электронов должен испытывать действие явлений дифракции и интерференции. Волновая природа электронов подтвердилась при наблюдении дифракции электронного пучка в структуре кристаллической решётки. Поскольку электрон обладает волновыми свойствами, положение его внутри объёма атома не определено. Положение электрона в атомном объёме описывается вероятностной функцией, если её изобразить в трёхмерном пространстве, то получим тела вращения
Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Быстро движущийся электрон находится в любой части пространства, окружающего ядро, и различные положения его рассматриваются как электронное облако, с определенной плотностью отрицательного заряда.
Атомная орбиталь – это геометрический образ, отвечающий объему пространства вокруг атомного ядра, который соответствует 90%-ой вероятности нахождения в этом объеме электрона (как частицы) и одновременно 90%-ой плотности заряда электрона (как волны).
Собственной характеристикой каждого электрона в атоме является спин. Два электрона, находящиеся в одной атомной орбитали, различаются по спину.
Форма электронных облаков
Согласно механистической модели форма электронного облака атома является следствием формы ядра атома. Источниками сил, связывающих атомы друг с другом, являются зоны перекрытия электронных облаков. Зоны перекрытия одновременно являются частью электронных облаков обоих соприкасающихся атомов. Чем больше зон перекрытия, тем крепче связь между атомами. Каждый электрон электронного облака на большей части своей траектории взаимодействует преимущественно с одним из протонов ядра, формируя часть электронного облака – электронный лепесток. Но в зонах перекрытия электроны могут переходить из одного электронного лепестка в другой.
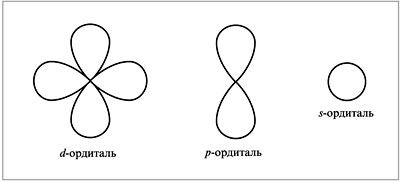
 . Число АО равно единице на s-энергетических подуровнях
. Число АО равно единице на s-энергетических подуровнях  , трем — на р-подуровнях
, трем — на р-подуровнях 

 , пяти — на d-подуровнях
, пяти — на d-подуровнях 



 и семи — на f-подуровнях
и семи — на f-подуровнях 





 .
.
