Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема.
Договорились растворенное вещество обозначать через X, а растворитель - через S.
Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю.
Массовая доля - это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора:
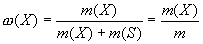 (1)
(1)
где ω(Х) - массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) - масса растворителя S, г; m= [m(Х) + m(S)] - масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например: ω = 0,01 или ω = 1%).
Молярная концентрация (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
С(Х) = v(Х) / V, (2)
где С(Х) - молярная концентрация растворенного вещества X, моль/л; v(Х) - количество растворенного вещества X, моль; V - объем раствора, л.
Как следует из (2), молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2МNаОН.
Мольная доля растворенного вещества - безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
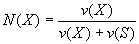 (3)
(3)
где N(Х) - мольная доля растворенного вещества X; v(Х) - количество растворенного вещества X, моль; v(S) - количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
N(X) + N(S) = 1. (4)
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) - массовая доля растворенного вещества, выраженная в %; М(Х) - молярная масса растворенного вещества, г/моль; р = m/(1000 V) - плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просторастворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
ks = mв-ва / mр-ля . (7)
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
s = (mв-ва / mр-ля) ∙ 100. (8)

