Константа ионизации воды: этот обратимый процесс приводит к образованию водородных и гидроксильных ионов.
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
pH=-lg[ H+ ]
В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению
H2O=H++OH-
Константа диссоциации при 22° С составляет
Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л.
Тогда:
C[ H+ ] ·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14
Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14.
Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+если известна концентрация ионов OH-
и наоборот: 
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны 
pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7
Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7.
Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7.
В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-]
Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
Произведение растворимости, произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита. Показатели степени для концентраций, входящих в произведение растворимости, равны коэффициенту при соответствующем ионе в уравнении диссоциацииэлектролита. Для неидеальных растворов концентрации должны быть заменены на активности и полученное произведение называетсяпроизведением активностей. При данной температуре и в данном растворителе произведение растворимости для каждого электролита есть характерная постоянная величина.
Постоянство произведения растворимости выводится из действующих масс закона и представляет собой частную форму этого закона в приложении к равновесию твёрдый электролит Û его насыщенный раствор. При этом предполагается, что в растворе электролит находится в полностью диссоциированной форме. Произведение растворимости наиболее точно измеряется методом эдс. Часто для измерения произведения растворимости используют также определение растворимости по электропроводности насыщенных растворов. Для многих соединенийпроизведение растворимости установлено с достаточной для практических целей точностью. В таблицах произведения растворимости обычно приводятся при температуре 25 °С (иногда при 18 °С).
Из правила постоянства произведения растворимости следует, что если произведение концентраций ионов в растворе превышает величинупроизведения растворимости, то выпадает осадок; в противном случае осадок не образуется. Это следствие позволяет регулировать содержаниеионов в растворе при использовании процессов осаждения, растворения, а также высаливания, имеющих большое значение в аналитической химиии химической технологии. Так, при увеличении концентрации одного из ионов путём введения в раствор нового электролита с одноимённымкатионом или анионом концентрация др. иона понижается за счёт выпадения части труднорастворимого электролита в осадок. Понижениерастворимости происходит обычно лишь до некоторого минимального значения, после чего может наблюдаться вновь повышение растворимостииз-за образования комплексных ионов или увеличения ионной силы раствора. Повышения растворимости можно достигнуть, связывая один из ионовв растворе, так что образуется др. ион, который не даёт малорастворимого соединения. Например, для перевода в раствор осадка СаСО3 ион 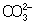 связывают с помощью иона Н+ в слабо диссоциированный ион
связывают с помощью иона Н+ в слабо диссоциированный ион 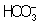 :
: 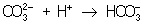 ; концентрация ионов
; концентрация ионов 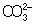 при этом уменьшается и осадок растворяется до тех пор, пока не будет достигнуто произведение растворимости.
при этом уменьшается и осадок растворяется до тех пор, пока не будет достигнуто произведение растворимости.

