1. Структурные особенности белков-ферментов. Мультиферментные комплексы. Функциональные компоненты ферментативных систем.
Ферменты как белки. Все ферменты являются белками, простыми или сложными (т.е. содержащими наряду с белковым компонентом небелковую часть).См. также БЕЛКИ.
Ферменты – крупные молекулы, их молекулярные массы лежат в диапазоне от 10 000 до более 1 000 000 дальтон (Да). Для сравнения укажем мол. массы известных веществ: глюкоза – 180, диоксид углерода – 44, аминокислоты – от 75 до 204 Да. Ферменты, катализирующие одинаковые химические реакции, но выделенные из клеток разных типов, различаются по свойствам и составу, однако обычно обладают определенным сходством структуры.
Структурные особенности ферментов, необходимые для их функционирования, легко утрачиваются. Так, при нагревании происходит перестройка белковой цепи, сопровождающаяся потерей каталитической активности. Важны также щелочные или кислотные свойства раствора. Большинство ферментов лучше всего «работают» в растворах, pH которых близок к 7, когда концентрация ионов H+ и OH- примерно одинакова. Связано это с тем, что структура белковых молекул, а следовательно, и активность ферментов сильно зависят от концентрации ионов водорода в среде.
Не все белки, присутствующие в живых организмах, являются ферментами. Так, иную функцию выполняют структурные белки, многие специфические белки крови, белковые гормоны и т.д.
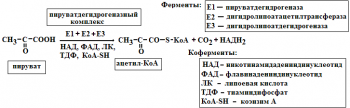
Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными фермен тами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
2. Холестерин и его производные. Эйкозаноиды
Холестери́н (др.-греч. χολή — желчь и στερεός — твёрдый) — органическое соединение, природный полициклический липофильный спирт, содержащийся в клеточных мембранах всех живых организмов, за исключением грибов и безъядерных (прокариоты).
Холестерин обеспечивает устойчивость клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов (включая кортизол, альдостерон, половые гормоны: эстрогены, прогестерон, тестостерон), жёлчных кислот[2].
Эйкозаноиды — окисленные производные полиненасыщенных жирных кислот — эйкозотриеновой (С20:3), арахидоновой (эйкозотетраеновая, С20:4), тимнодоновой (эйкозопентаеновая, С20:5). Пищевыми источниками полиненасыщенных жирных кислот являются растительные масла, рыбий жир и препараты омега-3-жирных кислот. Эйкозаноиды участвуют во множестве процессов, таких как рост мышечной ткани, раздражение и реакциях иммунитета на введенные токсины и патогены. Некоторые эйкозаноиды являются нейромедиаторами и гормонами. Эйкозаноиды синтезируются из омега-3 (ω-3) и омега-6 (ω-6) жирных кислот. В целом, омега-6 эйказаноиды являются провоспалительными. Количество и баланс этих липидов может влиять на состояние сердечно-сосудистой системы, кровяного давления, и состояние костей.
3. Активация аминокислот; аминоацил-тРНК-синтетазы и механизм коррекции ошибок в процессе синтеза аминоацил-тРНК
Активация аминокислот представляет собой реакцию присоединения аминокислоты к транспортной РНК перед вступлением в процесс трансляции. Данная реакция является промежуточной в процессе соединения аминокислоты с молекулой АТФ (аденозинтрифосфорная кислота). После этой реакции аминокислота присоединяется к тРНК с освобождением АМФ (аденозинмонофосфорная кислота).
Для каждой из двадцати аминокислот имеется соответствующая аминоацил-тРНК-лигаза, соединяющая в цитоплазме аминокислоту с тPHK. Процесс активации аминокислот проходит в два этапа. Изначально аминокислота связывается с ферментом и реагирует с АТФ (АТР), в результате чего образуется аминоациладенилат — макроэргический смешанный ангидрид. После этого аминоацильный остаток перемещается на 3'-ОН-группу остатка рибозы тРНК. Карбоксильная группа аминокислотного остатка в аминоацил-тРНК этерифицируется остатком рибозы 3'-концевого остатка аденозина, который входит в последовательность ССА-3'.
На точность трансляции, прежде всего, влияет субстратная специфичность аминоацил-тРНК-лигазы. Беспромедлительное удаление ложно присоединенных аминокислотных остатков осуществляется за счет корректирующего механизма активного центра лигазы. В среднем на 1300 аминокислотных остатков встречается только одна ошибка.