1. Вторичная структура белка. Факторы, определяющие вторичную структуру белка. Типы вторичных структур: β-слои, β-поворот. Роль аминокислотных радикалов в формировании вторичной структуры
В 1951 Лайнус Полинг и Роберт Кори, на основании анализа шаростержневых моделей предложили два основных типа образования вторичной структуры белков α-спираль и β-слой
Втори́чная структу́ра белка́ — пространственная структура, образующаяся в результате взаимодействия между функциональными группами пептидного остова.
Вторичная структура – это упорядоченное расположение основной цепи полипептида безотносительно к типам боковых цепей и их конформациям Вторичная структура белка стабилизирована водородными связями О‒‒Н•••••О N‒‒H•••••O O‒‒H•••••N N‒‒H•••••N
Регулярными называются вторичные структуры, образованные аминокислотными остатками с одинаковой конформацией главной цепи (углы φ и ψ), при разнообразии конформаций боковых групп.
К регулярным вторичным структурам относят:
спирали, которые могут быть левозакрученными и правозакрученными с разным периодом и шагом. Большинство спиральных структур в полипептидных цепях поддерживается внутримолекулярными водородными связями. Водородная связь при этом образуется между карбонильной группой одного аминокислотного остатка и аминогруппой другого, лежащего ближе к N-концу полипептида[2]. Разные типы спиралей описываются цифровой записью вида ab, где a — номер по цепи аминокислотного остатка, который предоставляет аминогруппу для формирования водородной связи, b — количество атомов в цикле, замкнутом водородной связью. К спиральным структурам, которые встречаются в белках, относятся: α-спираль, или спираль 413, — самая распространённая в белках вторичная структура. Данная спираль характеризуется плотными витками вокруг длинной оси молекулы, один виток составляет 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[3] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная.
310-спираль — очень «тугая» спираль, в сечении имеет форму треугольника, в белках встречается в основном её правая форма, и то только в виде 1-2 витков[2].
π-спираль, или спираль 516, — спираль с широкими витками, в результате в центре спирали остаётся пустое пространство. В белках встречается редко, обычно не более одного витка. β-листы (β-структура, складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[3]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Полипептидные цепи в составе β-листов могут быть направлены N-концами в противоположные стороны (антипараллельная β-структура), в одну сторону (параллельная β-структура), также возможно существование смешанной β-структуры (состоит из параллельной и антипараллельной β-структуры)[2]. Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин. β-структура является второй по частоте встречаемости в белках после α-спирали. полипролиновая спираль — плотная левая спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется в полипептидных цепях богатых пролином, где формирование насыщенной системы водородных связей по этой причине невозможно. Полипролиновая спираль типа poly(Pro)II реализуется в коллагене, при этом три левых полипролиновых спирали перевиваются в правую суперспираль, которая стабилизируется водородными связями между отдельными цепями[2].
Нерегулярные вторичные структуры
Нерегулярными называют стандартные вторичные структуры, аминокислотные остатки которых имеют разную конформацию главной цепи (углы φ и ψ). К нерегулярным вторичным структурам относят:
повороты — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 180°. Если участок, обеспечивающий поворот, достаточно длинный, используется термин петля. В 1968 году при описании поворотов из минимально возможного числа аминокислотных остатков (4) Венкатачалам ввёл для них термин β-изгиб[4]. Также существуют повороты из 4, 5 и 6 аминокислотных остатков.
полуповороты, или переходы, — нерегулярные участки полипептидной цепи, которые обеспечивают поворот её направления на 90°. Минимальный полуповорот состоит из 3 аминокислотных остатков.
Характеристики α-спирали: Правозакрученная спираль
Водородные связи образуются между i-м и i+4-м остатком; длина водородной связи примерно 0,20 нм
Водородные связи локализованы внутри спирали; все а.к.о. участвуют в образовании водородных связей, кроме первой и последней
Шаг спирали 0,54 нм
Каждая аминокислота соответствует повороту спирали на 100º
На один полный поворот спирали приходится 3,6 а.к.о.
Между а.к.о. расстояние по оси спирали составляет 0,15 нм
Торсионные углы изменяются в пределах: φ= -47 to -50 º and ψ=-60º
Роль аминокислотных радикалов в формировании вторичной структуры
α-спираль:
Ala, Leu, Met, Glu, Arg, Lys: благоприятны
Pro, Gly, Tyr, Ser: неблагоприятны
β-слой
Tyr, Trp, Ile, Val, Thr, Cys, Phe – благоприятны (большие радикалы)
Препятствуют образованию вторичной структуры:
Gly: слишком маленький радикал
Pro: образует жесткую струтуру
Asp, Asn, Ser:водородные связи, образуемые боковыми радикалами, конкурируют с водородными связями пептидного остова
2. Гетерополисахариды – структура и биологическая роль
http://studopedia.org/4-15353.html
Гетерополисахариды
Полисахариды, в структуре которых характерно наличие двух или более типов мономерных звеньев, носят название гетерополисахаридов.
Принято считать, что, поскольку гетерополисахариды чаще состоят только из двух различных мономеров, расположенных повторяющимся образом, они не являются информационными молекулами [Бохински Р., 1987].
Важнейшие представители гетерополисахаридов в органах и тканях животных и человека – гликозаминогликаны (мукополисахариды). Они состоят из цепей сложных углеводов, содержащих аминосахара и уроновые кислоты.
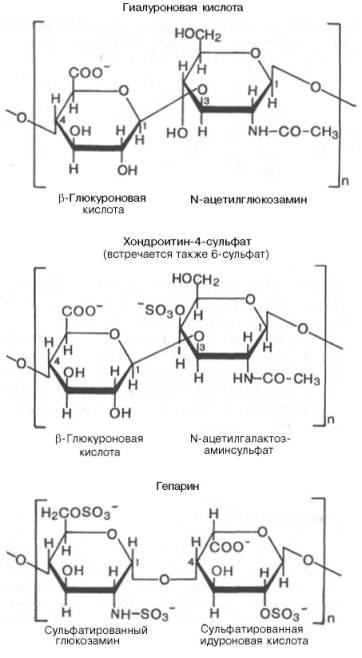
Рис. 5 . 5 . Строение некоторых сложных полисахаридов (гликозамино-гликанов).
Рис. 5.6. Протеогликановый агрегат (схема).
Единая длинная молекула гиалуро-ната (1) нековалентно связана со многими молекулами белка (2), каждая из которых содержит кова-лентно связанные молекулы хонд-роитинсульфата (3) и кератансуль-фата (4).
Различают шесть основных классов гликозаминогликанов (см. главу 21). Каждый из гликозаминогликанов содержит характерную для него повторяющуюся дисахаридную единицу; во всех случаях (кроме кератансульфатов) эта единица содержит либо глюкуроновую, либо идуроновую кислоту. Все гликозаминогликаны, за исключением гиалуроновой кислоты, содержат остатки моносахаридов с О- или N-сульфатной группой.
Гликозаминогликаны значительно различаются по размерам, их молекулярные массы в пределах от 104 Да для гепарина до 107 Да для гиалуроновой кислоты.
Выделенные индивидуальные гликозаминогликаны могут содержать смесь цепей различной длины (рис. 5.5). Гликозаминогликаны как основное скрепляющее вещество связаны со структурными компонентами костей и соединительной ткани. Их функция состоит также в удержании большой массы воды и в заполнении межклеточного пространства. Иными словами, гликозаминогликаны – основной компонент внеклеточного вещества – жела-тинообразного вещества, заполняющего межклеточное пространство тканей. Они также содержатся в больших количествах в синовиальной жидкости – это вязкий материал, окружающий суставы, который служит смазкой и амортизатором.
Поскольку водные растворы гликозаминогликанов гелеобразны, их называют мукополисахаридами.
Наконец, если цепи гликозаминогликана присоединены к белковой молекуле, соответствующее соединение называют протеогликаном.
Протеогликаны образуют основное вещество внеклеточного матрикса. В отличие от простых гликопротеинов, которые содержат только несколько процентов углеводов (по массе), протеогликаны могут содержать до 95% (и более) углеводов (рис. 5.6).
3. Биосинтез ДНК – репликация. Биохимические основы матричного синтеза ДНК. Суммарное уравнение синтеза ДНК; промежуточные и конечные продукты реакции полимеризации
Матричный биосинтез – процесс сборки новых макромолекул из мономеров, последовательность которых запрограммирована с помощью нуклеиновых кислот. Молекулы, используемые в качестве программы в матричном биосинтезе, называют матрицами. репликация ДНК происходит в ядре, предшествует делению клеток, в результате чего дочерние клетки получают полный набор генов;
Репликация – процесс самоудвоения ДНК, или биосинтез дочерней молекулы ДНК, полностью идентичной исходной молекуле (матрице). Локализация процесса – клеточное ядро. Основные принципы репликации ДНК:
комплементарность - синтезируемые цепи комплементарны матрице;
антипараллельность - 5'-конец синтезируемой полинуклеотидной цепи находится напротив 3'-конца матрицы и наоборот;
униполярность - синтез полинуклеотидных цепей происходит всегда в направлении 5' → 3';
потребность в затравке - ферменты, синтезирующие ДНК, способны лишь наращивать существующую полинуклеотидную цепь, поэтому вначале синтезируется короткая цепь РНК (затравка или праймер), к которой присоединяются дезоксирибонуклеотиды; выполнившая свою роль РНК-затравка удаляется;
прерывистость - одна из дочерних цепей (лидирующая) в процессе репликации растёт непрерывно, а другая (отстающая) - в виде фрагментов длиной в несколько сот нуклеотидов (фрагментов Оказаки);
полуконсервативность - в результате репликации образуются две двойные дочерние ДНК, каждая из которых сохраняет (консервирует) в неизменном виде одну из половин материнской ДНК.
4.4.2. Условия, необходимые для репликации ДНК:
1) Матрица – молекула ДНК (рисунок 26.1, а);
2) Расплетающие белки – разрывают водородные связи между комплементарными основаниями двойной спирали ДНК, в результате чего образуется репликативная вилка (рисунок 26.1, б);
3) ДНК-связываюшие белки - присоединяются к разделившимся цепям ДНК и препятствуют их обратному воссоединению; 4) Праймаза (РНК-полимераза) - фермент, синтезирующий затравочную РНК. 5) Субстраты и источники энергии – дезоксирибонуклеозидтрифосфаты (дАТФ, дГТФ, дТТФ, дЦТФ). Присоединяются к азотистым основаниям полинуклеотидных цепей при помощи водородных связей по принципу комплементарности;
6) ДНК-полимераза – фермент, который формирует из нуклеозидтрифосфатов новые полинуклеотидные цепи за счёт образования 3’,5’-фосфодиэфирных связей. Источником энергии служат макроэргические связи нуклеозидтрифосфатов. На одной ветви репликативной вилки синтезируется непрерывная цепь, на другой – фрагменты Оказаки (рисунок 26.1, в);
7) ДНК-лигаза – фермент, соединяющий фрагменты Оказаки в единую цепь (рисунок 26.1, г).
В результате образуются две идентичные молекулы ДНК (рисунок 26.1, д).
Суммарное уравнение синтеза ДНК может быть представлено в виде нескольких вариантов. Один из этих вари-антов следующий: Материнская цепь ДНК * п(дАТФ) + т(дГТФ) + р(дЦТФ) + ц(дТТФ) ———>
Рспликазный
————————————-—————> Дочерняя молекула ДНК + Ф~Ф(п+т+р+с]) комплекс
Ферменты: ДНК-иолимераза, ДНК-хеликаза

