1. Вторичная структура белка. Факторы, определяющие вторичную структуру белка. Типы вторичных структур: спирали.
Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN.
|
По обеим сторонам жесткой пептидной связи возможно вращение: y и j -углы, характеризующие вращение относительно одинарных связей С a -C и C a -N. |
Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями. Известны несколько способов укладки полипептидной цепи: a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок.
|
Конформация полипептидных цепей: а - a -спираль, б - b -складчатый лист. |
В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи:
 |
Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей a -спирали, b -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. Существует несколько видов взаимодействия между R-группами, в основном нековалентного характера:
 |
Связи, стабилизирующие третичную структуру:
- электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи);
- водородные связи между полярными (гидрофильными) R-группами;
- гидрофобные взаимодействия между неполярными (гидрофобными) R-группами;
- дисульфидные связи между радикалами двух молекул цистеина. Эти связи ковалентные. Они повышают стабильность третичной структуры, но не всегда являются обязательными для правильного скручивания молекулы. В ряде белков они могут вообще отсутствовать.

Пространственная структура миоглобина.
В полипептидной цепи показаны только a -углеродные атомы. Красным показан гем (небелковый компонент).
Доменные белки содержат обособленные глобулы - домены, образованные одной и той же пептидной цепью. Домены соединены пептидными перемычками. Вторичная и третичная укладка полипептидной цепи белка полностью определяется его первичной структурой.
2. Гомополисахариды – структура и биологическая роль
http://studopedia.ru/2_97498_gomopolisaharidi.html
Гомополисахариды
По своему функциональному назначению гомополисахариды могут быть разделены на две группы: структурные и резервные полисахариды. Важным структурным гомополисахаридом является целлюлоза, а главными резервными – гликоген и крахмал (у животных и растений соответственно).
Строгая классификация по химическому строению или биологической роли вследствие отсутствия для многих полисахаридов исчерпывающих данных невозможна. Поэтому чаще всего полисахариды «именуются» по источникам выделения, несмотря на то что один и тот же полисахарид может быть получен из совершенно разных источников.
Крахмал, как отмечалось, является основным резервным материалом растительных организмов. В небольших количествах он содержится в листьях, но главным образом накапливается в семенах (зерна злаков, например пшеницы, риса, кукурузы, содержат до 70% крахмала), а также в луковицах, клубнях и сердцевине стебля растений, где содержание его доходит до 30%.
Крахмал представляет собой смесь 2 гомополисахаридов: линейного – амилозы и разветвленного – амилопектина, общая формула которых (С6Н10О5)n. Как правило, содержание амилозы в крахмале составляет 10–30%, амилопектина – 70–90%. Полисахариды крахмала построены из остатков D-глюкозы, соединенных в амилозе и линейных цепях амило-пектина α-1–>4-связями, а в точках ветвления амилопектина – межцепочечными α-1–>6-связями:
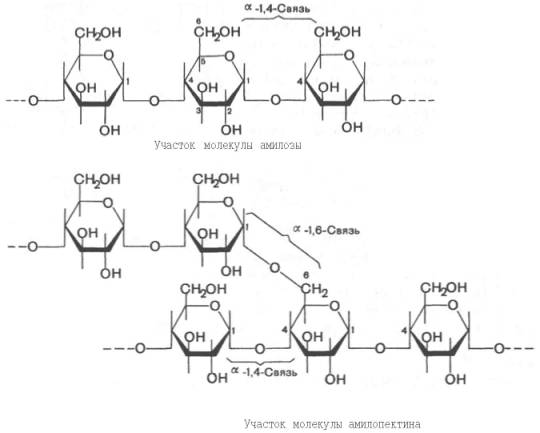
Итак, единственным моносахаридом, входящим в состав крахмала, является D-глюкоза. В молекуле амилозы линейно связано в среднем около 1000 остатков глюкозы; отдельные участки молекулы амилопектина состоят из 20–30 таких единиц. В настоящее время общепринятой является «ветвистая» структура отдельных цепочек с α-1–>4-связями в молекуле амилопектина (рис. 5.3).
Известно, что в воде амилоза не дает истинного раствора. Цепочка амилозы в воде образует гидратированныемицеллы. В растворе при добавлении йода амилоза окрашивается в синий цвет. Амилопектин также дает мицеллярный раствор, но форма мицелл несколько иная. Полисахарид амилопектин окрашивается йодом в красно-фиолетовый цвет.
Крахмал имеет молекулярную массу 105–107 Да. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степени полимеризации – декстрины , при полном гидролизе – глюкоза.
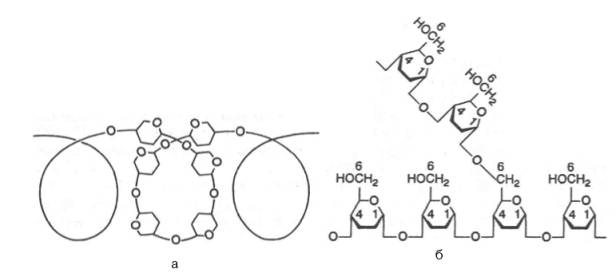
Рис. 5.3. Структура крахмала: а - амилоза с характерной для нее спиральной структурой; б - амилопектин, образующий в точках ветвления связи типа 1-6.
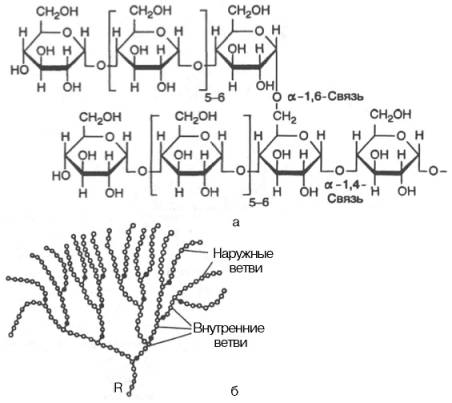
Рис. 5.4. Строение отдельного участка (а) и всей молекулы (б) гликогена (по Майеру). Белые кружки - остатки глюкозы, соединенные α-1,4-связью; черные кружки - остатки глюкозы, присоединенные α-1,6-связью; R - редуцирующая концевая группа. Внутренние цепи, или ветви,- участки между точками ветвления. Наружные цепи, или ветви, начинаются от точки ветвления и кончаются нередуцирующим остатком глюкозы.
Для человека крахмал является важным пищевым углеводом; содержание его в муке составляет 75–80%, в картофеле – 25%.
Гликоген – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы. Эмпирическая формула гликогена, как и крахмала, (С6Н10О5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество обнаружено в печени и мышцах. Молекулярная массагликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1–>4-гликозидными связями. В точках ветвления имеются α-1–>6-гликозидные связи. По строению гликоген близок к амилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нередуци-рующего конца цепи (рис. 5.4).
Гликоген характеризуется более разветвленной структурой, чем амило-пектин; линейные отрезки в молекулегликогена включают 11–18 остатков α-D-глюкопиранозы.
При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
Инулин – полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. При его гидролизе образуется фруктоза, следовательно, он представляет собой фруктазан.
Метилирование инулина свидетельствует, что остатки D-фруктозы связаны между собой 2–>1-связями и находятся в фуранозной форме:
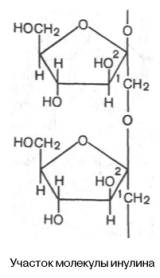
Степень полимеризации инулина равна примерно 35 моносахарным остаткам. Этот полисахарид в отличие от картофельного крахмала легко растворяется в теплой воде. Инулин используют в физиологических исследованиях для определения скорости клубочковой фильтрации в почках.
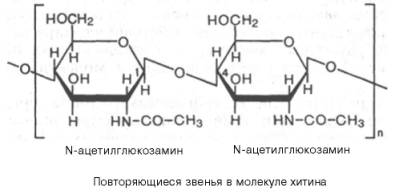
Хитин – важный структурный полисахарид беспозвоночных животных (главным образом членистоногих). Из него, в частности, построен наружный скелет ракообразных и насекомых.
Хитин также частично или полностью замещает целлюлозу в клеточных стенках сапрофитных растений, например грибов.
Структуру хитина составляют N-ацетил-D-глюкозаминовые звенья, соединенные β-(1–>4)-гликозидными связями:
Целлюлоза (клетчатка) – наиболее широко распространенный структурный полисахарид растительного мира. Он состоит из α-глюкозных остатков в их β-пиранозной форме, т.е. в молекуле целлюлозы β-глюко-пиранозные мономерные единицы линейно соединены между собой β-(1–>4)-связями:
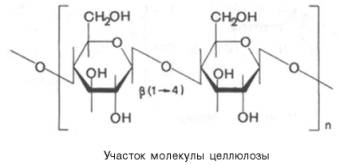
При частичном гидролизе целлюлозы образуется дисахарид целлобиоза, а при полном гидролизе – D-глюкоза. Молекулярная масса целлюлозы 1000–2000 кДа. Клетчатка не переваривается ферментами пищеварительного тракта, так как набор этих ферментов у человека не содержит гидролаз, расщепляющих β-связи. В связи с этимцеллюлозу можно рассматривать как значительный неиспользуемый «пищевой» резерв. Вместе с тем известно, что присутствие оптимальных количеств клетчатки в пище способствует формированию кала. При полном исключении клетчатки из пищи нарушается формирование каловых масс.
В кишечнике жвачных и других травоядных животных имеются микроорганизмы, способные к ферментативному расщеплению β-связей (β-глю-козидных связей), и для этих животных целлюлоза является важным источником пищевых калорий.
Наконец, целлюлоза и ее производные имеют колоссальное практическое значение. Основная масса целлюлозы используется для изготовления хлопчатобумажных тканей и бумаги. Кроме того, на основе целлюлозы производятся искусственные волокна, пластмассы и т.д. Характерной особенностью целлюлозы, определяющей в значительной степени ее механические, физико-химические и химические свойства, является линейная конформация молекул, закрепленная внутримолекулярными водородными связями.
3. Пространственная организация ДНК в клетке. Компактизация ДНК: нуклеоид, хроматин. Роль ковалентных посттрансляционных модификаций гистонов.
Местонахождением генетической информации в клетке является ядерная ДНК Основным ядерным материалом является дезоксирибонуклеиновая кислота (ДНК), которая в интерфазном ядре образует нити различной толщины (в среднем 10 нм, но иногда всего лишь 2 нм). Толщина нитей зависит от присутствия или отсутствия белков, окружающих двойную спираль ДНК. Длина нитей зависит от молекулярной массы ДНК, одна хромосома с молекулярной массой до 1012 содержит ДНК, длина которой составляет несколько сантиметров. Количество ядерной ДНК зависит от источника выделения (около 6 пг содержатся в клетке млекопитающих) и довольно постоянно в различных клетках данного вида. Нуклеоид (означает подобный ядру, также известен как ядерная область) — компартмент неправильной формы внутри клетки прокариот, в котором находится генетический материал. ДНК нуклеоида имеет замкнутую кольцевую форму. Такой способ хранения наследственной информации может быть противопоставлен способу эукариот, у которых ДНК упакована в хромосомы и изолирована имеющей мембрану органеллой — ядром. Хроматин (греч. χρώματα — цвета, краски) — это вещество хромосом, представляющее собой комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК[1]. До 25—40% сухого веса хроматина составляют гистоновые белки[2]. Гистоны являются компонентом нуклеосом, надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из гистонов четырёх типов: H2A, H2B, H3 и H4. Эти гистоны называются кóровыми. В одну нуклеосому входят по два кóровых гистона каждого типа — всего восемь белков. Линкерный гистон H1, более крупный, чем кóровые гистоны, связывается с ДНК в месте её входа на нуклеосому[3].
МОДИФИКАЦИЯ ГИСТОНОВ
Структура коровых гистонов эволюционно консервативна, но их гибкие N-концевые хвосты могут претерпевать многочисленные посттрансляционные ковалентные модификации (табл. 1), включая ацетилирование, метилирование, фосфори-лирование, убиквитинирование и т.д. [10, 11]. Специфическая модификация может действовать как компонент гистонового кода, привлекая белки, узнающие модифицированный остаток. Посттрансляционная модификация гистонов может модулировать структуру хроматина, например, ослаблять взаимодействие гистонов с ДНК, позволяя хроматину "дышать" и, таким образом, способствовать развитию различных процессов; кроме того, модификация гистонов играет важную роль в хроматиновой наследственности [1]. В соответствии с теорией гистонового кода, модификации гистонов "действуют" последовательно или в комбинации друг с другом и, таким образом, привлекают связывающие белки для выполнения специфических задач [5]. Предполагается также, что разные участки одной хромосомы различаются по функции благодаря разным сложным наборам гистонов с различными модификациями, что "привлекает" различные хроматин-связыва-ющие белки.



