1. Принципы структурной организации белков. Основные функции белков. Иерархия структурно-функциональной организации живых систем
Принято выделять четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная и четвертичная структура. Рассмотрим особенности каждого из этих уровней.
2.1.1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. 1.4.2). Имейте в виду, что даже небольшие изменения первичной структуры белка могут значительно изменять его свойства. Примером заболеваний, развивающихся в результате изменения первичной структуры белка, являются гемоглобинопатии (гемоглобинозы) .
В эритроцитах здоровых взрослых людей присутствует гемоглобин А (Hb А) . В крови некоторых людей содержится аномальный (изменённый) гемоглобин - гемоглобин (Hb S). Единственное отличие первичной структуры Hb S от Hb A - замена гидрофильного остатка глутаминовой кислоты на гидрофобный остаток валина в концевом участке их β-цепей:
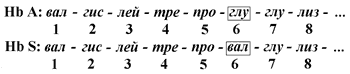
Как известно, основная функция гемоглобина -транспорт кислорода к тканям. В условиях пониженного парциального давления О2 снижается растворимость гемоглобина S в воде и его способность связывать и переносить кислород. Эритроциты принимают при этом серповидную форму, быстро разрушаются, вследствие чего развивается малокровие (серповидно-клеточная анемия] .
Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белка. Установлено, что каждой полипептидной последовательности соответствует только один стабильный вариант пространственной структуры. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг.
До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, без участия каких-либо компонентов. Однако сравнительно недавно обнаружилось, что это справедливо только для сравнительно небольших белков (порядка 100 аминокислотных остатков). В процессе фолдинга более крупных белков принимают участие специальные протеины - шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка.
2.1.2. Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО-и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α-спираль и β-складчатый слой.
α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм (рисунок 2.1).
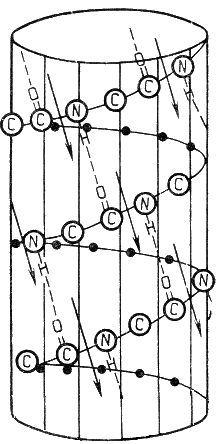
Рисунок 2.1. α-Спираль.
Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль.
β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.
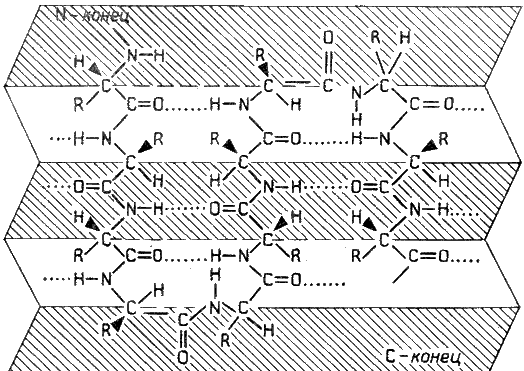
Рисунок 2.2. β-Складчатый слой.
Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации.
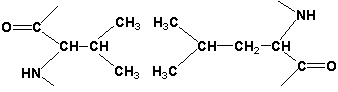
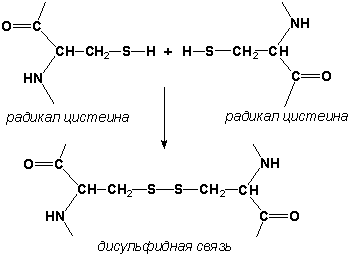
2.1.3. Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
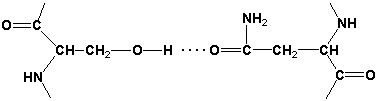
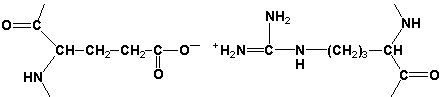
- Водородные связи образуются между двумя полярными незаряженными радикалами или между незаряженным и заряженным радикалами, например, радикалами серина и глутамина:
- Ионные связи могут возникать между противоположно заряженными радикаламинапример, радикалами глутамата и аргинина:
- Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина:
- Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи:
.
По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
- Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
- Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
- Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся:
- Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
- Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
- Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
2.1.4. Четвертичная структура белка - размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка.Четвертичная структура - высший уровень организации белковой молекулы, к тому же необязательный - более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, - субъединицами или протомерами. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями разных типов.
Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем объединяется с другими путём самосборки. Каждая субъединица содержит участки, способные взаимодействовать с соответствующими участками других субъединиц. Эти взаимодействия осуществляются посредством водородных, ионных и гидрофобных связей между радикалами аминокислот, входящих в состав разных цепей.
Олигомерные белки могут существовать в виде нескольких устойчивых конформаций и обладают аллостерическими свойствами, то есть способны переходить из одной конформаций в другую с изменением своей функциональной активности. Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент фосфофруктокиназа и многие другие.
Более подробно структурная организация и функционирование олигомерных белков будут рассмотрены в следующей теме на примере гемоглобина (рисунок 2.3).
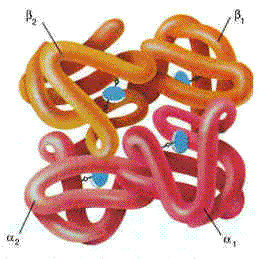
Рисунок 2.3. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом.
Известны также белки, модекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (инсулин, тромбин). Подобные белки нельзя олигомерными. Такие белки образуются из единой полипептидной цепи в результате частичного протеолиза - локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают.
2.2.1. Белки играют важнейшую роль в организме, выполняя многообразные биологические функции.Запомните наиболее важные из них и примеры соответствующих белков, изучив таблицу 2.2.
Таблица 2.2
Функциональная классификация белков
| Функция белка | Сущность | Примеры |
|---|---|---|
| Каталитическая (ферментативная) | Ускорение химических реакций в организме | Пепсин, трипсин, каталаза, цитохромоксидаза |
| Транспортная | Транспорт (перенос) химических соединений в организме | Гемоглобин, альбумин, трансферрин |
| Структурная пластическая | Обеспечение прочности и эластичности тканей | Коллаген, эластин, кератин |
| Сократительная | Укорочение саркомеров мышцы (сокращение) | Актин, миозин |
| Гормональная (регуляторная) | Регуляция обмена веществ в клетках и тканях | инсулин, соматотропин, глюкагон, кортикотрспин |
| Защитная | Защита организма от повреждающих факторов | Интерфероны, иммуноглобулины |
| Энергетическая | Высвобождение энергии за счёт распада аминокислот | Белки пищи и тканей |
2.2.2. Обратите внимание на то, что в основе функционирования любого белка лежит его способность к избирательному взаимодействию со строго определёнными молекулами или ионами (лигандами) . Например, для ферментов, катализирующих химические реакции, лигандами будут вещества, участвующие в этих реакциях (субстраты), для транспортных белков - транспортируемые вещества и т.д.
2.2.3. Лиганд способен взаимодействовать не со всей поверхностью белковой молекулы, а только с определённым её участком, который представляет собой центр связывания или активный центр. Этот центр формируется пространственно сближенными радикалами аминокислот на уровне вторичной или третичной структуры белка. Способность лиганда взаимодействовать с центром связывания обусловлена их комплементарностью, то есть взаимным соответствием их пространственной структуры (подобно взаимодействию «ключ - замок»). Между функциональными группами лиганда и центра связывания образуются нековалентные (водородные, ионные, гидрофобные), а также ковалентные связи. Комплементарностью лиганда и центра связывания можно объяснить высокую специфичность (избирательность) взаимодействия белок - лиганд.
Важно отметить, что изменение пространственной структуры белка в процессе денатурации (см. 2.4) приводит к разрушению центров связывания и утрате биологической функции белка.
Для живых систем характерно иерархическое усложнение организации. Выделяют несколько уровней организации живой материи.
1) В основе процессов жизнедеятельности лежат процессы превращения веществ, в результате которых образуются сложные молекулы — полисахариды, липиды, белки и нуклеиновые кислоты. Эти молекулы образуют сложные специфические комплексы, выполняющие все функции, свойственные живому. Они формируют молекулярный уровень организации живого. Однако любой такой комплекс сам по себе не является живым.
2) Все проявления живого мы наблюдаем на следующем, клеточном уровне. Клетка является элементарной структурной и функциональной единицей живого. Она служит основой роста, развития и размножения многоклеточных организмов. Она также является минимальной единицей живого, способной к самостоятельному существованию либо в виде одноклеточных организмов, либо в виде культивируемых клеток многоклеточных.
3) Все живое на земле существует в виде обособленных единиц — особей, которые формируют организменный уровень. В случае одноклеточных организмов особью является каждая отдельная клетка. У многоклеточных между клеточным и организменным уровнями формируются дополнительные уровни: тканевый и органный. Тканевый уровень формируется при объединении клеток одного или нескольких типов, выполняющих общую функцию. Органный уровень представлен сложными образованиями, выполняющими определенные функции и отделенными от других частей организма.
4) Следующий уровень — популяционно-видовой. Надорганизменные системы — популяции и виды — объединяют особей, имеющих сходное строение и дающих плодовитое потомство. Для популяции характерна также общность занимаемой территории, тогда как особи одного вида могут занимать разные территории, принадлежа разным популяциям. Вид представляет собой сумму популяций. На этом уровне осуществляются основные эволюционные процессы.
5) Биогеоценотический (экосистемный) уровень представляет собой результат взаимодействия популяций разных видов, проживающих на одной территории, и природных условий этой территории. Биогеоценозы представляют собой устойчивые исторически сложившиеся динамические сообщества. При этом они не являются полностью изолированными друг от друга.
6) В результате взаимодействия биоценозов формируется высший уровень организации живого на земле — биосферный. На этом уровне происходят круговороты веществ и энергии. Биосфера так же, как и биогеоценозы, представляет собой динамическую, постоянно изменяющуюся систему.
Процессы, характерные для различных уровней организации живой природы
|
Уровень организации |
Процессы |
|
молекулярный |
объединение молекул в комплексы; химические реакции; хранение и запись генетической информации |
|
клеточный
|
обмен веществ и энергии; этап трансляции в биосинтезе белка; рост и регенерация |
|
организменный
|
дифференцировка клеток и тканей; обмен веществ; регуляция жизнедеятельности (поддержание гомеостаза); раздражимость; размножение |
|
популяционно-видовой |
взаимодействие между особями и популяциями внутри вида (!); адаптация к окружающей среде; эволюционные процессы |
|
биогеоценотический |
межвидовые взаимодействия; круговороты веществ и энергии; регуляция динамического равновесия компонентов биогеоценоза |
|
биосферный |
активное взаимодействие живого и неживого планеты; биологический глобальный круговорот веществ и энергии |
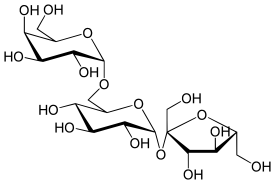
2. Углеводы. Классификация и номенклатура углеводов. Структура и физико-химические свойства моносахаридов
Углево́ды — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп[1]. Название класса соединений происходит от слов «гидраты углерода», оно было впервые предложено К. Шмидтом в 1844 году. Появление такого названия связано с тем, что первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y, формально являясь соединениями углерода и воды.
Сахара́ — другое название низкомолекулярных углеводов (моносахаридов, дисахаридов и олигосахаридов).
Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира, составляя (по массе) основную часть органического вещества на Земле. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями.
Углеводы — весьма обширный класс органических соединений, среди них встречаются вещества с сильно различающимися свойствами. Это позволяет углеводам выполнять разнообразные функции в живых организмах. Соединения этого класса составляют около 80 % сухой массы растений и 2—3 % массы животных[1].
Классификация
Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы — дисахариды, от двух до десяти единиц — олигосахариды, а более десяти — полисахариды. Моносахариды быстро повышают содержание сахара в крови и обладают высоким гликемическим индексом, поэтому их ещё называют быстрыми углеводами. Они легко растворяются в воде и синтезируются в зелёных растениях. Углеводы, состоящие из 3 или более единиц, называются сложными. Продукты, богатые сложными углеводами, постепенно повышают содержание глюкозы и имеют низкий гликемический индекс, поэтому их ещё называют медленными углеводами. Сложные углеводы являются продуктами поликонденсации простых сахаров (моносахаридов) и, в отличие от простых, в процессе гидролитического расщепления способны распадаться на мономеры с образованием сотен и тысяч молекул моносахаридов.

Моносахари́ды (от греческого monos — единственный, sacchar — сахар) — простейшие углеводы, не гидролизующиеся с образованием более простых углеводов — обычно представляют собой бесцветные, легко растворимые в воде, плохо — в спирте и совсем нерастворимые в эфире, твёрдые прозрачные органические соединения[2], одна из основных групп углеводов, самая простая форма сахара. Водные растворы имеют нейтральную pH. Некоторые моносахариды обладают сладким вкусом. Моносахариды содержат карбонильную (альдегидную или кетонную) группу, поэтому их можно рассматривать как производные многоатомных спиртов. Моносахарид, у которого карбонильная группа расположена в конце цепи, представляет собой альдегид и называется альдоза. При любом другом положении карбонильной группы моносахарид является кетоном и называется кетоза. В зависимости от длины углеродной цепи (от трёх до десяти атомов) различают триозы, тетрозы, пентозы, гексозы, гептозы и так далее. Среди них наибольшее распространение в природе получили пентозы и гексозы[2]. Моносахариды — стандартные блоки, из которых синтезируются дисахариды, олигосахариды и полисахариды.
В природе в свободном виде наиболее распространена D-глюкоза (C6H12O6) — структурная единица многих дисахаридов (мальтозы, сахарозы и лактозы) и полисахаридов (целлюлоза, крахмал). Другие моносахариды, в основном, известны как компоненты ди-, олиго- или полисахаридов и в свободном состоянии встречаются редко. Природные полисахариды служат основными источниками моносахаридов[2].
Дисахариды[править | править вики-текст]
Дисахари́ды (от di — два, sacchar — сахар) — сложные органические соединения, одна из основных групп углеводов, при гидролизе каждая молекула распадается на две молекулы моносахаридов, являются частным случаем олигосахаридов. По строению дисахариды представляют собой гликозиды, в которых две молекулы моносахаридов соединены друг с другом гликозидной связью, образованной в результате взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). В зависимости от строения дисахариды делятся на две группы: восстанавливающие и невосстанавливающие. Например, в молекуле мальтозы у второго остатка моносахарида (глюкозы) имеется свободный полуацетальный гидроксил, придающий данному дисахариду восстанавливающие свойства. Дисахариды наряду с полисахаридами являются одним из основных источников углеводов в рационе человека и животных[3].
Олигосахариды[править | править вики-текст]
О́лигосахари́ды (от греч. ὀλίγος — немногий) — углеводы, молекулы которых синтезированы из 2—10 остатков моносахаридов, соединённых гликозидными связями. Соответственно различают: дисахариды, трисахариды и так далее[3]. Олигосахариды, состоящие из одинаковых моносахаридных остатков, называют гомополисахаридами, а из разных — гетерополисахаридами. Наиболее распространены среди олигосахаридов дисахариды.
Среди природных трисахаридов наиболее распространена рафиноза — невосстанавливающий олигосахарид, содержащий остатки фруктозы, глюкозы и галактозы — в больших количествах содержится в сахарной свёкле и во многих других растениях[3].
Полисахариды[править | править вики-текст]
Полисахари́ды — общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов. С точки зрения общих принципов строения в группе полисахаридов возможно различить гомополисахариды, синтезированные из однотипных моносахаридных единиц и гетерополисахариды, для которых характерно наличие двух или нескольких типов мономерных остатков[4].
Гомополисахариды (гликаны), состоящие из остатков одного моносахарида, могут быть гексозами или пентозами, то есть в качестве мономера может быть использована гексоза или пентоза. В зависимости от химической природы полисахарида различают глюканы (из остатков глюкозы), маннаны (из маннозы), галактаны (из галактозы) и другие подобные соединения. К группе гомополисахаридов относятся органические соединения растительного (крахмал, целлюлоза, пектиновые вещества), животного (гликоген, хитин) и бактериального (декстраны) происхождения[2].
Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Это один из основных источников энергии организма, образующейся в результате обмена веществ. Полисахариды принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.
Крахма́л
(C6H10O5)n — смесь двух гомополисахаридов: линейного — амилозы и разветвлённого — амилопектина, мономером которых является альфа-глюкоза. Белое аморфное вещество, не растворимое в холодной воде, способное к набуханию и частично растворимое в горячей воде[2]. Молекулярная масса 105—107 Дальтон. Крахмал, синтезируемый разными растениями в хлоропластах, под действием света при фотосинтезе, несколько различается по структуре зёрен, степени полимеризации молекул, строению полимерных цепей и физико-химическим свойствам. Как правило, содержание амилозы в крахмале составляет 10—30 %, амилопектина — 70—90 %. Молекула амилозы содержит в среднем около 1 000 остатков глюкозы, связанных между собой альфа-1,4-связями. Отдельные линейные участки молекулы амилопектина состоят из 20—30 таких единиц, а в точках ветвления амилопектина остатки глюкозы связаны межцепочечными альфа-1,6-связями. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степени полимеризации — декстрины (C6H10O5)p, а при полном гидролизе — глюкоза[4].
Гликоге́н (C6H10O5)n — полисахарид, построенный из остатков альфа-D-глюкозы — главный резервный полисахарид высших животных и человека, содержится в виде гранул в цитоплазме клеток практически во всех органах и тканях, однако, наибольшее его количество накапливается в мышцах и печени. Молекула гликогена построена из ветвящихся полиглюкозидных цепей, в линейной последовательности которых, остатки глюкозы соединены посредством альфа-1,4-связями, а в точках ветвления межцепочечными альфа-1,6-связями. Эмпирическая формула гликогена идентична формуле крахмала. По химическому строению гликоген близок к амилопектину с более выраженной разветвлённостью цепей, поэтому иногда называется неточным термином «животный крахмал». Молекулярная масса 105—108 Дальтон и выше[4]. В организмах животных является структурным и функциональным аналогом полисахарида растений — крахмала. Гликоген образует энергетический резерв, который при необходимости восполнить внезапный недостаток глюкозы может быть быстро мобилизован — сильное разветвление его молекулы ведёт к наличию большого числа концевых остатков, обеспечивающих возможность быстрого отщепления нужного количества молекул глюкозы[2]. В отличие от запаса триглицеридов (жиров) запас гликогена не настолько ёмок (в калориях на грамм). Только гликоген, запасённый в клетках печени (гепатоцитах) может быть переработан в глюкозу для питания всего организма, при этом гепатоциты способны накапливать до 8 процентов своего веса в виде гликогена, что является максимальной концентрацией среди всех видов клеток. Общая масса гликогена в печени взрослых может достигать 100—120 граммов. В мышцах гликоген расщепляется на глюкозу исключительно для локального потребления и накапливается в гораздо меньших концентрациях (не более 1 % от общей массы мышц), тем не менее общий запас в мышцах может превышать запас, накопленный в гепатоцитах.
Целлюло́за (клетча́тка) — наиболее распространённый структурный полисахарид растительного мира, состоящий из остатков альфа-глюкозы, представленных в бета-пиранозной форме. Таким образом, в молекуле целлюлозы бета-глюкопиранозные мономерные единицы линейно соединены между собой бета-1,4-связями. При частичном гидролизе целлюлозы образуется дисахарид целлобиоза, а при полном — D-глюкоза. В желудочно-кишечном тракте человека целлюлоза не переваривается, так как набор пищеварительных ферментов не содержит бета-глюкозидазу. Тем не менее, наличие оптимального количества растительной клетчатки в пище способствует нормальному формированию каловых масс[4]. Обладая большой механической прочностью, целлюлоза выполняет роль опорного материала растений, например, в составе древесины её доля варьирует от 50 до 70 %, а хлопок представляет собой практически стопроцентную целлюлозу[2].
Хити́н — структурный полисахарид низших растений, грибов и беспозвоночных животных (в основном роговые оболочки членистоногих — насекомых и ракообразных). Хитин, подобно целлюлозе в растениях, выполняет опорные и механические функции в организмах грибов и животных. Молекула хитина построена из остатков N-ацетил-D-глюкозамина, связанных между собой бета-1,4-гликозидными связями. Макромолекулы хитина неразветвлённые и их пространственная укладка не имеет ничего общего с целлюлозой[2].
Пекти́новые вещества́ — полигалактуроновая кислота, содержится в плодах и овощах, остатки D-галактуроновой кислоты связаны альфа-1,4-гликозидными связями. В присутствии органических кислот способны к желеобразованию, применяются в пищевой промышленности для приготовления желе и мармелада. Некоторые пектиновые вещества оказывают противоязвенный эффект и являются активной составляющей ряда фармацевтических препаратов, например, производное подорожника «плантаглюцид»[2].
Мурами́н (лат. múrus — стенка) — полисахарид, опорно-механический материал клеточной стенки бактерий. По химическому строению представляет собой неразветвлённую цепь, построенную из чередующихся остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединённых бета-1,4-гликозидной связью. Мурамин по структурной организации (неразветвлённая цепь бета-1,4-полиглюкопиранозного скелета) и функциональной роли весьма близок к хитину и целлюлозе[2].
Декстра́ны — полисахариды бактериального происхождения — синтезируются в условиях промышленного производства микробиологическим путём (воздействием микроорганизмов Leuconostoc mesenteroides на раствор сахарозы) и используются в качестве заменителей плазмы крови (так называемые клинические «декстраны»: Полиглюкин и другие)[2].
3. Полимерная структура ДНК. Полярность цепи. Структура фосфодиэфирной связи
https://ru.wikipedia.org/wiki/%D0%94%D0%B5%D0%B7%D0%BE%D0%BA%D1%81%D0%B8%D1%80%D0%B8%D0%B1%D0%BE%D0%BD%D1%83%D0%BA%D0%BB%D0%B5%D0%B8%D0%BD%D0%BE%D0%B2%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0