ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ, один из осн. законов термодинамики; является законом сохранения энергии для систем, в к-рых существ, значение имеют тепловые процессы (поглощение или выделение тепла). Согласно первому началу термодинамики, термодинамич. система (напр.,пар в тепловой машине) может совершать работу только за счет своей внутр. энергии или к.-л. внеш. источника энергии. Первое началотермодинамики часто формулируют как невозможность существования вечного двигателя первого рода, к-рый совершал бы работу, не черпая энергию из нек-рого источника.
Первое начало термодинамики вводит представление о внутренней энергии системы как ф-ции состояния. При сообщении системе нек-рого кол-ва теплоты Q происходит изменение внутр. энергии системы DU и система совершает работу А:
DU = Q + А.
Первое начало термодинамики утверждает, что каждое состояние системы характеризуется определенным значением внутр. энергии U, независимо от того, каким путем приведена система в данное состояние. В отличие от значений U значения A и Q зависят от процесса, приведшего к изменению состояния системы. Если начальное и конечное состояния a и b бесконечно близки (переходы между такими состояниями наз. инфи-нитезимальными процессами), первое начало термодинамики записывается в виде:
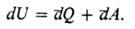
Это означает, что бесконечно малое изменение внутр. энергии dU является полным дифференциалом ф-ции состояния, т.е. интеграл 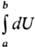 = Ub — Ua , тогда как бесконечно малые кол-ва теплоты
= Ub — Ua , тогда как бесконечно малые кол-ва теплоты 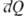 и работы
и работы 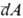 не являются дифференц. величинами, т.е. интегралы от этих бесконечно малых величин зависят от выбранного пути перехода между состояниями а и b (иногда их наз. неполными дифференциалами).
не являются дифференц. величинами, т.е. интегралы от этих бесконечно малых величин зависят от выбранного пути перехода между состояниями а и b (иногда их наз. неполными дифференциалами).
Из общего кол-ва работы, производимой системой объема У, можно выделить работу обратимого изотермич. расширения под действием внеш.давления pe, равную peV, и все остальные виды работы, каждый из к-рых можно представить произведением нек-рой обобщенной силы 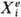 , действующей на систему со стороны окружающей среды, на обобщенную координату xi , изменяющуюся под воздействием соответствующей обобщенной силы. Для инфинитези-мального процесса
, действующей на систему со стороны окружающей среды, на обобщенную координату xi , изменяющуюся под воздействием соответствующей обобщенной силы. Для инфинитези-мального процесса
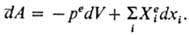
Первое начало термодинамики позволяет рассчитать макс. работу, получаемую при изотермич. расширении идеального газа, изотермич. испарениижидкости при пост. давлении, устанавливать законы адиабатич. расширения газов и др. Первое начало термодинамики является основойтермохимии, рассматривающей системы, в к-рых теплота поглощается или выделяется в результате хим. р-ций, фазовых превращ. или растворения(разбавления р-ров).
Если система обменивается со средой не только энергией, но и в-вом (см. Открытая система), изменение внутр. энергии системы при переходе из начального состояния в конечное включает помимо работы А и теплоты Q еще и т. наз. энергию массы Z. Бесконечно малое кол-во энергии массы в инфинитезимальном процессе определяется хим. потенциалами mk каждого из компонентов системы:  =
=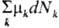 , где dNk - бесконечно малое изменение числа молей k-гo компонента в результате обмена со средой.
, где dNk - бесконечно малое изменение числа молей k-гo компонента в результате обмена со средой.
В случае квазистатич. процесса, при к-ром система в каждый момент времени находится в равновесии с окружающей средой, первое началотермодинамики в общем виде имеет след. мат. выражение:
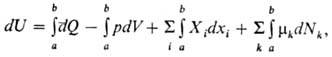
где p и mk равны соответствующим значениям для окружающей среды (индекс е при Xi обычно опускают). Это выражение используется в прикладнойтермодинамике применительно к системам, в к-рых производится работа хим., электрич., магн. и т.п. сил.
Первое начало термодинамики было сформулировано в сер. 19 в. в результате работ Ю. P. Майера, Дж. Джоуля и Г. Гельмгольца. Вместе со вторым началом термодинамики оно составляет основу классич. термодинамики. В 60-х гг. 20 в. сформулирован фундам. закон устойчивого равновесиясистем (Д. Хацо-пулос, Д. Кинан, P. Хейвуд), следствиями к-рого являются как первое начало термодинамики, так и второе начало.

