В 1867 г. голландцы К. Гульдберг и П. Вааге установили характер этой зависимости и открыли основной закон химической кинетики – закон действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению мгновенных концентраций, возведенных в степени их стехиометрических коэффициентов.
При этом стехиометрические коэффициенты должны отражать механизм элементарных актов реакции.
Кинетическое уравнение, отражающее механизм взаимодействия, может быть получено только в результате экспериментального изучения реакций и не всегда совпадает с суммарным стехиометрическим уравнением.
Для реакции в общем виде: формальное условное кинетическое уравнение прямой реакции
формальное условное кинетическое уравнение прямой реакции  , обратной –
, обратной –  .
.
Вид кинетического уравнения зависит от порядка реакции.
В общем случае постулат химической кинетики для реакции можно выразить в общем виде как  , где коэффициенты n1, n2определяют порядок реакции по данному компоненту (коэффициенты n могут быть целочисленными, дробными или равными нулю.
, где коэффициенты n1, n2определяют порядок реакции по данному компоненту (коэффициенты n могут быть целочисленными, дробными или равными нулю.
Экспериментальные исследования показали, что скорость реакции зависит от многих факторов:
1) природы рагирующих веществ;
2) концентрации;
3) температуры;
4) физического состояния вещества;
5) влияния катализаторов;
6) влияния инициаторов;
7) влияния электромагнитного излучения.
Зависимость скорости реакции от температуры.
Энергия активации
Физическую сущность k раскрывает зависимость, установленная в 1884 г. Я. Вант-Гоффом из молекулярно-кинетических представлений для элементарных химических реакций, известная как уравнение Аррениуса:
 ,
,
где предэкспоненциальный множитель А – постоянная Аррениуса (частотный фактор), связанная с частотой столкновения молекул, участвующих в реакции и их ориентацией в пространстве, может быть вычислена теоретически из молекулярно-кинетической теории или статистической термодинамики; Еа – по С. Аррениусу (1889 г.) энергия активации, ранее рассматривалась в химической кинетике как эмпирическая постоянная, не зависящая от температуры. В настоящее время появилась возможность ее приближенной оценки с помощью методов квантовой химии; R – универсальная газовая постоянная, равная 8,313 Дж/(моль×К); Т – термодинамическая температура, К.
Влияние на скорость реакции температуры С. Аррениус трактовал как сдвиг равновесия между неактивными и активными молекулами. (Основной вклад С. Аррениуса в развитие химической кинетики состоит во введении представлений об энергии активации как потенциальном барьере, который должны преодолеть реагирующие молекулы прежде, чем стать продуктами реакции).
Как видно из уравнения Аррениуса, зависимость скорости химической реакции u @ k от температуры имеет экспоненциальный характер, что согласуется с концепцией «активных частиц» и теорией «активных столкновений» в химической кинетике.
Энергию активации в простейшем варианте можно определить по константам скорости при двух разных температурах:
 .
.
Зависимость скорости химической реакции от температуры в небольшом интервале температур описывает эмпирическое правило Вант-Гоффа:при изменении температуры на каждые 10 градусов скорость большинства химических реакций изменяется в 2–4 раза.
Математическое выражение правила Вант-Гоффа:
 ,
,
где  и
и  – скорости химических реакций при температурах Т1 и Т2;
– скорости химических реакций при температурах Т1 и Т2;
g – температурный коэффициент (коэффициент Вант-Гоффа), определяется экспериментально.
Связь между температурным коэффициентом и энергией активации выражается уравнением
 или
или 
Согласно закону действия масс скорость простой реакции равна

КОНСТАНТА СКOРОСТИ реакции, коэффициент пропорциональности в кинетич. ур-нии хим. р-ции, выражающем зависимость скорости р-ции v от концентрации к.-л. из компонентов реакц. смеси. Для бимолекулярных р-ций типа vAA+vBB: продукты, протекающих при постоянном объеме, согласнодействующих масс закону, 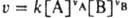 , где vA и vB - стехиометрич. коэф. реагирующих в-в А и В, k -константа скорости; численно k=v при [А]=[В]=1 моль/л. Для мономолекулярных р-ций константа скорости имеет размерность с-1, для бимолекулярных - л/моль.с, для тримолекулярных - л2/моль2.с. Помимо истиннойконстанты скорости часто имеют дело с эффективной константой скорости kэфф в рассматриваемом эксперименте; если, напр., бимолекулярная р-ция между А и В происходит при большом избытке в-ва В иконцентрация [В] практически не меняется, кинетич. ур-ние р-ции м.б. записано в виде:
, где vA и vB - стехиометрич. коэф. реагирующих в-в А и В, k -константа скорости; численно k=v при [А]=[В]=1 моль/л. Для мономолекулярных р-ций константа скорости имеет размерность с-1, для бимолекулярных - л/моль.с, для тримолекулярных - л2/моль2.с. Помимо истиннойконстанты скорости часто имеют дело с эффективной константой скорости kэфф в рассматриваемом эксперименте; если, напр., бимолекулярная р-ция между А и В происходит при большом избытке в-ва В иконцентрация [В] практически не меняется, кинетич. ур-ние р-ции м.б. записано в виде: 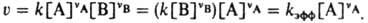
Для сложных р-ций, протекающих в неск. стадий, часто скорость р-ции не м.б. представлена как простая пропорциональная зависимость v от концентрации реагентов и выражается более сложным ур-нием, напр.: v=k'[A][B](l+k:[В])-1; тогда k' и k: наз. коэффициентами в ур-нии для скорости р-ции. Если скорость сложной р-ции м.б. выражена через произведение концентраций реагентов, то коэф. пропорциональности k наз. коэффициентом скорости или эффективной константой скорости. Если р-ция между А и В протекает на пов-сти (напр., катализатора) и ее скорость v~[А][В]S (S - площадь пов-сти), то k = v/[A][В]S чаще всего рассматривают как эмпирическую (кажущуюся) константу скорости. Зависимость константа скорости от т-ры Г выражается Аррениуса уравнением: k=Aехр(-E/RT), где А - предэкспоненц. множитель, Е - энергия активации р-ции, R - газовая постоянная. Значения констант скорости изменяются с т-рой в широких пределах, напр. для бимолекулярных р-ций - от 1010 до 10-10 л/моль.с. Константа скорости -фундам. кинетич. характеристика р-ции в данных условиях (фаза, среда, т-ра, давление), не зависящая от концентрацийреагентов. Нахождение константы скорости из эксперим. данных наз. обратной задачей хим. кинетики; использование известных констант скорости для расчета концентраций компонентов реакц. смеси в данный момент времени (при известных начальных концентрациях) в хим. кинетике наз. прямой задачей


