Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса.
Так, в комплексном катионе [Cu(NH3)4]2+внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными.
Обозначается внутренняя сфера квадратными скобками: [Fe(CN)6]3-, [HgI4]2-, [SnCl6]2-.
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, [Al(H2O)6]3+, либо отрицательный, например, [Ag(SO3S)2]3-, или нулевой заряд, например, как для [Cr(NH3)3(NCS)3]0.
Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения.
Например, в комплексном соединении [Zn(NH3)4]Cl2 два иона Cl- находятся во внешней сфере:
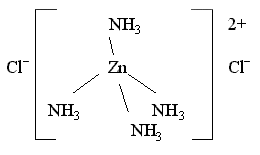
Внешнесферные ионы Cl- находятся на более значительном удалении от комплексообразователя, чем молекулы NH3, иначе говоря, расстояние Zn – Cl больше, чем длина химической связи Zn – N. Более того, химическая связь комплексного катиона [Zn(NH3)4]2+ и хлорид-ионов Cl- имеет ионный характер, в то время как молекулы аммиака NH3, входящие во внутреннюю сферу, образуют с комплексообразователем Zn(II) ковалентные связи по донорно-акцепторному механизму (донором неподеленных пар электронов являются атомы азота в NH3). Таким образом, различие между лигандами внутренней сферы и ионами внешней сферы очень существенно.
Изображая формулу комплексного соединения, внешнесферные ионы располагают за квадратными скобками.
Например, в соединениях [Cu(NH3)4](OH)2 и K2[HgI4] внешнесферными ионами являются соответственно ионы OH- и K+. Вполне понятно, что в нейтральных комплексах [Cr(NH3)3(NCS)3]0 и [Pd(NH3)2Cl2]0 внешняя сфера отсутствует.
Обычно внешнюю сферу составляют простые одноатомные или многоатомные ионы. Однако возможны случаи, когда комплексное соединение состоит из двух и более внутренних сфер, выполняющих функции катионной и анионной части соединения. Здеськаждая из внутренних сфер является внешней по отношению к другой.
Например, в соединениях [Cu(NH3)4][PtCl6] и [Ni(NH3)6]2[Fe(CN)6] формально функции внешнесферных ионов могут выполнять:
· комплексные катионы [Cu(NH3)4]2+ и [Ni(NH3)6]2+,
· комплексные анионы [PtCl6]2- и [Fe(CN)6]4-.
При растворении в воде комплексные соединения необратимо диссоциируютна ионы:
[Cu(NH3)4](OH)2 = [Cu(NH3)4]2+ + 2 OH-
[Ni(NH3)6]2[Fe(CN)6] = 2 [Ni(NH3)6]2+ + [Fe(CN)6]4-
Кислоты с комплексными анионами в водном растворе подвергаются необратимому котолизу:
H2[SiF6] + 2 H2O = 2 H3O+ + [SiF6]2-
Такие кислоты относятся к категории сильных кислот.

