Химическая промышленность
Химическая промышленность: Химическая промышленность при производстве аммиака, метанола, мыла и пластмасс.
Пищевая промышленность: при производстве маргарина из жидких растительных масел, зарегистрирован в качестве пищевой добавки E949 (упаковочный газ, класс «Прочие»), входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции.
Авиационная промышленность: водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо: водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар. В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
В лабаратории
В лаборатории водород обычно получают в аппарате Киппа по реакции:
Zn + 2HCl = ZnCl2 + H2
Если для реакции берут серную кислоту, то водород может содержать следы сероводорода.
Можно привести еще ряд реакций, которые приводят к получению водорода:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2Na + 2H2O = 2NaOH + H2,
CaH2 + 2H2O = Ca(OH)2 + 2H2,
3Fe + 4H2O = Fe3O4 + 4H2 .
Вода.
Большую часть нашей планеты — 79 % — занимает вода, и даже если углубиться в толщу земной коры, то в трещинах и порах можно обнаружить воду. Кроме того, все известные на Земле минералы и живые организмы имеют в своем составе воду.
Велико значение воды в природе. Современные научные исследования воды дают возможность рассматривать се как уникальное вещество. Она участвует во всех физико-географических, биологических, геохимических и геофизических процессах, происходящих на Земле, является движущей силой многих глобальных процессов на планете.
Вода вызвала на Земле такое явление, как круговорот воды — замкнутый, непрерывный процесс перемещения воды, охватывающий все важнейшие оболочки Земли. Движущей силой круговорота воды служит солнечная энергия, вызывающая испарение воды (с океанов в 6,6 раза больше, чем с суши). Поступившая в атмосферу вода переносится воздушными течениями в горизонтальном направлении, конденсируется и под действием силы тяжести падает на Землю в форме осадков. Одна часть их через реки поступает в озера и океан, а другая — идет на увлажнение почвы и пополнение подземных вод, которые принимают участие в питании рек, озер и морей.
В годовой круговорот вовлечено 525,1 тыс. км3 воды. В среднем за год на нашей планете выпадает 1030 мм осадков и примерно столько же испаряется (в объемных единицах 525 000 км3).
Равенство между количеством воды, поступающим на поверхность Земли с осадками, и количеством воды, испаряющей с поверхности Мирового океана и суши, за одинаковый период времени называется водным балансом нашей планеты
Вода. Водородная связь.
Ни одна из планет Солнечной системы не содержит на своей поверхности такого большого количества воды, как наша Земля. Моря и океаны, средняя глубина которых около 6 км, покрывают 71 % поверхности Земли. Огромное количество воды в виде снега и льда сосредоточено в приполярных районах.
Этот удивительный факт пока не нашел однозначного объяснения. Безусловно, вода играет огромную роль в возникновении и существовании жизни на нашей планете. Во многом это связано со свойствами, которых нет у ее ближайших соседей и аналогов (H2S, H2Se и т.д. – см. таблицу 7-1 в предыдущем параграфе). Прежде всего нужно разобраться, почему вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Молекула воды имеет следующее строение:
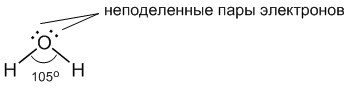
Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга (вспомните §3.6). Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов. Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Для возникновения водородных связей важно, чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но электроотрицательными атомами, например: O, N, F. Это создает заметный частичный положительный заряд на атомах водорода. С другой стороны, важно, чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует с неподеленной электронной парой на атоме N, O или F другой молекулы (донор), то возникает связь, похожая на полярную ковалентную.
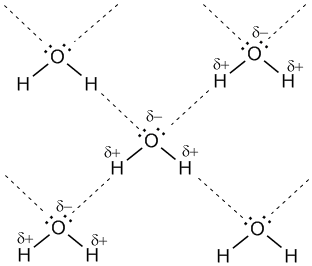
Рис. 7-1а. Водородные связи между молекулами воды (обозначены пунктиром).
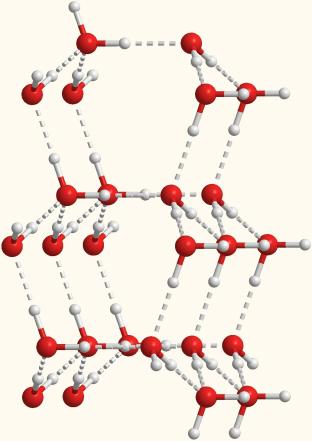
Рис. 7-1б. Объемная модель, показывающая расположение молекул воды, связанных водородными связями.
Перокси́д водоро́да
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с«металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивогокристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение: 
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённыеэлектронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.

