Дисперсная система — это система, в которой мелкие частицы одной или нескольких веществ равномерно распределены между частицами другого вещества.Дисперсной фазой называют мелкие частицы вещества которое распределено в системе.
Дисперсийной средой называют вещество в котором распределена дисперсная фаза.
Гомогенная (однородная) дисперсная система – это система в которой между дисперсной фазой и дисперсионной средой нет поверхности раздела.
Гетерогенная (неоднородная) дисперсная система – это система в которой частицы дисперсной фазы имеют размер больше чем 1·10-9м и составляют отдельную фазу от дисперсионной среды.
Классификация дисперсных систем.
1. Классификация по степени дисперсности. В зависимости от размеров частиц дисперсные системы разделяют на такие типы:
а) грубодисперсные (d= 10-3-10-5 м) к ним принадлежат грубые суспензии, эмульсии, порошки.
б) средней дисперсности (d= 10-5-10-7 м) к ним принадлежат тонкие суспензии, дым, пористые тела.
в) высокодисперсные (d= 10-7-10-9 м) это коллоидные системы.
2. Классификация по агрегатному состоянию. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды (газообразное- Г, жидкое- Ж, твердое-Т) можно разделить 9 типов дисперсных систем.
Таблица 1. Основные типы дисперсных систем
|
|

3. Классификация по межфазовому взаимодействию. У дисперсных системах на границе раздела фаз действуют силы взаимодействия между частицами дисперсной фазы и дисперсионной среды. В зависимости от их интенсивности системы разделяют на лиофобные и лиофильные.
а) лиофобные это системы, в которых слабые силы межмолекулярного взаимодействия. К ним принадлежат лиозоли, аэрозоли, эмульсии, пены. Лиофобные золи это коллоидные растворы.
б) лиофильные это системы, в которых интенсивное взаимодействие между фазой и средой. К ним принадлежат растворы высокомолекулярных соединений.
Грубодисперсные системы – системы, размер частиц дисперсной фазы в которых превышает 10-7 м.
Коллоидные системы – системы, размер частиц дисперсной фазы в которых составляет 10-7 – 10-9 м. Коллоидные системы характеризуются гетерогенностью, т.е. наличием поверхностей раздела фаз и очень большим значением удельной поверхности дисперсной фазы. Это обусловливает значительный вклад поверхностной фазы в состояние системы и приводит к появлению у коллоидных систем особых, присущих только им, свойств.
Иногда выделяют молекулярно(ионно)-дисперсные системы, которые, строго говоря, являются истинными растворами, т.е. гомогенными системами, поскольку в них нет поверхностей раздела фаз.
Коллоидные системы, в свою очередь, подразделяются на две группы, резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды – лиофобные коллоидные растворы (золи) и растворы высокомолекулярных соединений (ВМС), которые ранее называли лиофильными коллоидами. К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Растворы ВМС образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Лиофобные коллоиды и растворы ВМС различаются также и структурой частиц, составляющих дисперсную фазу. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла, для растворов ВМС – макромолекула.
2. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
В зависимости от содержания растворенного вещества растворы бывают разбавленные, концентрированные, насыщенные и перенасыщенные. Количественная характеристика способности вещества растворяться до образования насыщенного раствора называется растворимостью. Растворимость определяется как:
а) количество вещества в граммах, которое необходимо растворить в 100 г растворителя для получения насыщенного раствора (m(г) / 100 (г));
б) количество молей растворенного вещества, которое содержится в 1 л насыщенного раствора (моль / л).
В химической практике применяются растворы с различным содержанием растворенного вещества. Для таких растворов используют следующие способывыражения концентрации растворенного вещества: массовая доля и мольная доля растворенного вещества, молярная и моляльная концентрации, молярная концентрация эквивалента.
2.1 Массовая доля (С%)
или процентная концентрация определяет, какую часть масса растворенного вещества составляет от массы раствора (обычно в процентах), и рассчитывается как отношение
2.2 Молярная концентрация (См)
или молярность определяет, сколько молей растворенного вещества содержится в каждом литре данного раствора, и рассчитывается как отношение количества растворенного вещества в молях nм(х), содержащегося в растворе, к объему этого раствора:
2.3 Моляльная концентрация (Cm)
или моляльность определяет, сколько молей растворенного вещества приходятся на каждый килограмм растворителя, и рассчитывается как отношение количества растворенного вещества в молях n(х) к массе растворителя: 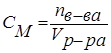
2.4 (СN)
или нормальность определяет, сколько молей эквивалента растворенного вещества содержится в каждом литре раствора, и рассчитывается как отношение количества растворенного вещества в молях эквивалента nэ(х), содержащегося в растворе, к объему этого раствора:
2.5 Мольная доля (Сm)
показывает, какую часть число молей растворенного вещества составляет от суммы числа молей растворенного вещества и растворителя в растворе. Для двухкомпонентного раствора состоящего из растворителя и одного растворенного вещества мольная доля рассчитывается по уравнению:
2 МЕТАЛЛЫ-в-ва, облад-е в обыч усл харак-ми,ме-ми, св-ми-высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью хорошо отражать световые волны (блеск), пластичностью.
Физические свойства металлов
Агрегатное состояние и температуры плавления. Температуры плавления металлов меняются в очень широких пределах. Самый легкоплавкий из металлов – ртуть – при комнатной температуре является жидкостью. Металл галлий плавится от теплоты человеческого тела. Наибольшую температуру плавления имеет вольфрам, Металлы с температурой плавления выше 1000oC1000oC принято называть тугоплавкими.
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
1) Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду ––Au,Ag,Cu,Sn,Pb,Zn,Fe® уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность.
Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду ––Ag,Cu,Al,Fe® уменьшается.
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
2) Следует обратить внимание на особенности взаимодействие металлов с водой:
- Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:Ca+2H2O=Ca(OH)2+H2↑Ca+2H2O=Ca(OH)2+H2↑
- Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
- Металлы средней активности окисляются водой при нагревании до оксида:
6Cr+6H2O−→−t,∘C2Cr2O3+3H2↑6Cr+6H2O→t,∘C2Cr2O3+3H2↑
Неактивные металлы (Au, Ag, Pt) - не реагируют с водой.
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
Mg+2HCl=MgCl2+H2Mg+2HCl=MgCl2+H2
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему "Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металла с оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
CuSO4+Fe=FeSO4+CuCuSO4+Fe=FeSO4+Cu
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
CuSO4+Pb=PbSO4↓+CuCuSO4+Pb=PbSO4↓+Cu
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
Общие химические свойства металлов обобщены в таблице:
| Уравнение реакции | Продукты реакции | Примечания |
|---|---|---|
| с простыми веществами - неметаллами | ||
| с кислородом | ||
|
4Li+O2=2Li2O4Li+O2=2Li2O
|
оксиды O−2O−2 | |
|
2Na+O2=Na2O22Na+O2=Na2O2
|
пероксиды (O2)−2(O2)−2 | только натрий |
|
K+O2=KO2K+O2=KO2
|
надпероксиды(O2)−2(O2)−2 | надпероксиды при горении образуют K, Rb, Cs |
| с водородом | ||
|
Ca+H2=CaH2Ca+H2=CaH2
|
гидриды | щелочные металлы 0 при комнатной температуре; остальные металлы - при нагревании |
| с галогенами | ||
|
Fe+Cl2=Fe+3Cl3Fe+Cl2=Fe+3Cl3 |
хлориды и др. |
при взаимодействии с хлором и бромом (сильные окислители) железо и хром образуют хлориды в степени окисления +3 |
| с серой | ||
|
Fe+S=FeSFe+S=FeS
|
сульфиды | при взаимодействии с серой и иодом железо приобретает степень окисления +2 |
| с азотом и фсофоромжелезо | ||
|
3Mg+N2=Mg3N23Mg+N2=Mg3N2
|
нитриды | * при комнатной температуре с азотом реагируют только литий и магний |
|
3Ca+2P=Ca3P23Ca+2P=Ca3P2
|
фосфиды | |
| с углеродом | ||
|
4Al+3C=Al4C34Al+3C=Al4C3
|
карбиды | |
| с водой | ||
|
2Na0+2H2O=2NaOH+H22Na0+2H2O=2NaOH+H2
|
Основание + H2H2 | щелочные металлы |
|
Zn0+H2O=ZnO+H2Zn0+H2O=ZnO+H2
|
Оксид + H2H2 | среднеактивные металлы, при нагревании |
|
Au,Ag,Pt+H2O/neAu,Ag,Pt+H2O/ne
|
не реагируют | неактивные металлы (после Н) |
| с окисдами менее активных металлов | ||
| 2Al+3ZnO=Al2O3+2Zn2Al+3ZnO=Al2O3+2Zn | др оксид + др.металл | |
| с солями менее активных металлов | ||
|
Fe+CuSO4=Cu+FeSO4Fe+CuSO4=Cu+FeSO4
|
Др. соль + др. металл |
|
|
Cu+AlCl3≠Cu+AlCl3≠
|
||
| с кислотами | ||
|
Fe+2HCl=FeCl2+H2Fe+2HCl=FeCl2+H2 6Na+2H3PO4=2Na3PO4+3H26Na+2H3PO4=2Na3PO4+3H2
|
Др. соль +водород | Металлы, стоящие в электрохимическом ряду напряжений до H реагируют с разбавленными кислотами (кроме HNO3HNO3) |
|
|
||

