1.1.сколько у одного тела отним., столько присоединится к др., а если сколько-то материи (в данном случае массы) исчезнет в одном месте, то увеличится в другом месте.
2.1 Сумма массы в-ва системы и массы, эквивалентной энергии, которая получена или отдана этой системой постоянна. Пруст закон пост сост, все соединения содерж эл-ты в строго определен вес пропорц, независимо от способа получения. Кратн."Любое хим-ки чист соединен независим от способа получен состт из одних и тех же хим эл, причем отношения масс эл-тов постоянны, а относительные числа их атомов выражаются цел числ."Авогадро: "В равн объемах различн газов, взятых при одинак значен темп и давлен, содер одно и то же число молекул."
 Галогены имеют много общего в строении атомов и молекул. У них завершается застройка р-оболочки внешнего слоя, поэтому все они р-элемент. Внешнему электронному слою атомов галогенов нет одного электрона, поэтому электроотрицательность выражена ярко и в овр они ведут себя в основном как окислители.
Галогены имеют много общего в строении атомов и молекул. У них завершается застройка р-оболочки внешнего слоя, поэтому все они р-элемент. Внешнему электронному слою атомов галогенов нет одного электрона, поэтому электроотрицательность выражена ярко и в овр они ведут себя в основном как окислители.
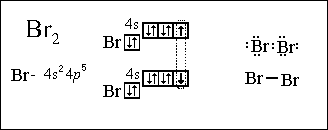
Молекулы галогенов состоят из д вух атомов (F2, Сl2, Вr2, l2), соединенных между собой посредством ковалентной неполярной связи. Между атомами в молекулах галогенов возникает одна общая электронная пара. одновалентны. Кристаллическая решетка галогенов молекулярного типа.
Атомы разных галогенов различаются числом эл-х слоев, радиусами. С возрастанием зарядов ядер радиусы атомов увеличиваются, что ведет к постепенному уменьшению величины электроотр-ти от фтора к иоду и снижению неметалличности свойств. Наиболее ярко выраженным неме фтор, наименее ярким — йод.
Все свойства галогенов, как физические, так и химические, зависят от строения атомов элементов. Эти свойства различных галогенов во многом сходны, но в то же время каждому галогену присущ ряд особенностей.
Фтор — газ светло-зеленого цвета, отличающийся чрезвычайно ядовитыми свойствами. Температура кипения фтора —188°, температура затвердевания —218°. Плотность 1,11 г/смъ.
Хлор — газ желто-зеленого цвета. Он также ядовит, имеет резкий, удушливый, неприятный запах. Хлор тяжелее воздуха, сравнительно хорошо растворяется в воде (на 1 объем воды 2 объема хлора), образуя хлорную воду; Cl2agi при температуре— 34° превращается в жидкость, а при— 101° затвердевает. Плотность 1,568 г/см3..
Бром —единственный жидкий неме. Это вещество красно-бурого цвета, тяжелое, летучее. Сосуд, в котором находится бром, всегда окрашен его парами в красно-бурый цвет.
Бром имеет тяжелый неприятный запах В воде растворяется плохо, образуя бромную воду Br2aq. Гораздо лучше бром растворяется в органических растворителях — бензоле, толуоле, хлороформе.
Хранят бром в склянках с притертыми пробками и притертыми колпаками. Резиновые пробки для работы с бромом, как и для работы с хлором, неприменимы, так-как они быстро разъедаются. Бром намного тяжелее воды (плотность 3,12 г/см3). Температура кипения брома 63°, температура затвердевания —7,3°.
Йод — вещество кристаллическое, темно-серого цвета, в парах — фиолетового. Плотность йода 4,93 г/см3, температура плавления 113°, температура кипения 184°. Довести йод до плавления, а тем более до кипения при обычных условиях не удается, так как уже при слабом нагревании он из твердого состояния сразу переходит в пар —возгоняется. Переход вещества из твердого состояния в газообразное, минуя жидкое, и обратно называется возгонкой. Это свойство характерно не только для йода, но и для некоторых других веществ. Его удобно использовать для очистки веществ от примесей.
Иод плохо растворяется в воде. Окраска йодной воды I2aq всегда светло-желтая. Но зато он прекрасно растворяется в спирте.
Распространенность фтора и хлора близка друг к другу и довольно велика (6,5 • 10-2% по массе и 4,5•10-2% соответственно); распространенность брома и иода гораздо меньше — 1,6•10-4 и 4 • 10-5%. Фтор играет определенную биологическую роль — от содержания его в воде зависит, в частности, состояние зубов, т.к. фторид кальция входит в состав зубной ткани.
Концентрация хлора (Сl-) в тканях организма относительно велика, и функции его разнообразны — они связаны с активацией ферментов, передачей нервного возбуждения и др. Функции брома изучены плохо, а иод, несомненно, играет очень важную роль, так как входит в состав гормона щитовидной железы — тироксина, определяющего общий темп окислительных процессов в организме.
I В природе в свободном состоянии хлор встречается в вулканических газах. Широко распространены его соединения: хлорид натрия NaCl, хлорид калия КСl, хлорид магния MgCl2•6H2O, сильвинит, состоящий из NaCl и КСl, карналлит состава КС1•MgCl2•6Н2О, каинит состава MgSO4•КСl•3Н2О и др.
1. Важнейший способ получения фтора — электролиз расплавов фторидов, где фтор выделяется на аноде:
2F--2e-F2
В качестве основного источника получения используется гидрофторид KHF2.
2. Хлор в лабораторных условиях получают из соляной кислоты при взаимодействии ее с оксидом марганца (IV). Реакция прорекает при нагревании.
4HСl-1+Mn+4O2=Сl02+Mn+2Сl2+2Н2O

Вместо окислителя MnO2 можно применить перманганат калия KMnO4. Тогда реакция протекает при обычной температуре,
16НСl-1+2KMn+7O4=5Сl02+2Mn+2Сl2+2КСl+8Н2О

В промышленности хлор получают электролизом раствора хлорида натрия. Газообразный хлор выделяется на аноде:
2NaCl+2Н2O электролиз2NaOH+H2+Cl2
3. Для получения брома чаще применяют реакцию замещения его в бромидах. 2KBr+Сl2=2KСl+Br2
4. Основные источники получения иода — это морские водоросли и нефтяные буровые воды.
2NaI+MnO2+3H2SO4=I2+2NaHSO4+MnSO4+2Н2О Получение иода из его природных источников сводится к переводу его в молекулярный:
2NaI+2NaNO2+2H2SO4=I2+2H2O+2NO+2Na2SO4
5. В лабораторных условиях бром и иод получают одним и тем же способом: действием оксида марганца (IV) на бромиды или иодиды в кислой среде, например:
MnO2+2KBr+2H2SO4=MnSO4+Br2+K2SO4+2Н2О

