Двойной электронный слой на поверхности раздела металл-раствор
На поверхности твердого тела при его контакте с жидкостью самопроизвольно возникает избыточный электрический заряд, который компенсируется противоионами. В результате, на границе Ж-Т возникает ДЭС. Образование ДЭС происходит самопроизвольно, вследствие стремления поверхностной энергии к минимуму и в связи с особыми свойствами границы раздела.
Возникновение на границе электрических зарядов характерно, прежде всего, для золей и суспензий, дисперсная фаза которых формируется из твердых частиц.
При погружении металла в раствор электролита, содержащего ионы этого металла, устанавливается электрохимическое равновесие. Если химический потенциал ионов металла mМ больше химического потенциала этих же ионов в растворе mр, то ионы переходят из металла в раствор, и поверхность металла заряжается отрицательно. И, наоборот, при помещении медной пластинки в раствор сульфата меди с достаточно высокой концентрацией соли, металлическая поверхность заряжается положительно.
Возникновение зарядов на твердом теле приводит к тому, что на границе раздела фаз возникает электрический потенциал, обозначаемый через j .
Если j-потенциал определяется активностью ионов в растворе, то есть твердое тело играет роль электрода, то для выражения его можно воспользоваться уравнением Нернста:

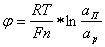 (5.1)
(5.1)
где n- заряд иона, F - число Фарадея, ап и ар -активности ионов у поверхности и в растворе.
Электродные потенциалы, уравнение Нернста, стандатный электродный потенциал, водородный электрод, гальванический элемент.
Каждая о-в реакция слагается из полуреакций окисления и восстановления. Когда реакция идет в гальваническом элементе или при электролизе, каждая полуреакция протекает на соответствующем электроде. Такие полуреакции - электродные процессы.
В соответствии с разделением о-в реакции на две полуреакции, ЭДС принято представлять в виде разности двух электродных потенциалов.
В электродных процессах их уравнения в сторону восстановления.
Величины потенциалов различных электродных процессов зависят от:
1) природы реаг веществ - участников электродного процесса;
2) соотношения между концентрациями этих веществ;
3) температуры системы.
Эта зависимость выражается уравнением Нернста:
Е= Е° +(0,059/n)lg([Оx]a[H+]z/[Red]b)
Концентрации, равные 1, стандартные (активности). Стандартный электродный потенциал - это потенциал данного электродного процесса при активностях всех участвующих в нем веществ, равных 1.
Для построения численной шкалы электродных потенциалов нужно потенциал какого-либоэлектродного процесса принять равным нулю.
Эталон: 2H+ + 2e = H2
этот процесс осуществляется на водородном электроде. Это платиновая пластинка, электролитически покрытая губчатой платиной и погруженная в раствор кислоты, через который пропускается водород.
Водород хорошо ра-ся в платине, его молекулы распадаются на атомы. На поверхности соприкосновения платины с раствором кислоты протекает окисление или восстановление ионов водорода. Платина играет роль губки, пропитанной атомарным водородом.
Гальванический элемент
Рассмотрим реакцию:
Zn + CuSO4 → ZnSO4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции:
Zn – 2e → Zn2+
Cu2+ + 2e → Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 6.1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.

Рисунок 6.1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд А и соединяющая оба сосуда трубка В заполнены раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO42–. Электрод, на котором происходит процесс восстановления (на рисунке 6.1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом.
В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах *. В более общем виде гетерогенный электродный процесс можно записать в виде:
Me (ВФ, тв. фаза) – ne–  Men+ (aq) (ОФ, раствор)
Men+ (aq) (ОФ, раствор)
На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Men+ (в растворе) и электронов (в металле), что приводит к появлению потенциала E(Men+/Me). Его абсолютная величина определению не поддается, однако легко измеряется разность потенциалов катода и анода, которая называется электродвижущей силой (ЭДС) гальванического элемента ΔE=Eк–Eа. Если в таких устройствах условно считать потенциал какого-то электрода равным нулю, то измерением ЭДС можно получить относительные значения других электродных потенциалов, что важно для сравнительной количественной характеристики электродов.
Условно за нуль принят потенциал стандартного водородного электрода, который состоит из платиновой пластинки, покрытой платиновой чернью и частично погруженной в раствор кислоты с активной концентрацией ионов водорода, равной 1 моль/л. Электрод омывается газообразным водородом под давлением 1,013·105 Па (1 атмосфера), что приводит к образованию системы:
2 H+ + 2e H2
H2
Для измерения электродных потенциалов металлов, например меди, составляют гальванический элемент, в котором вторым электродом служит стандартный водородный электрод. В основе работы составленного гальванического элемента лежит реакция
Cu2+ + H2 → 2H+ + Cu
На схеме гальванического элемента границы раздела фаз показывают одной вертикальной чертой, а электроды отделяют друг от друга двумя вертикальными чертами. Анод на схеме указывают слева, а катод – справа:
А (–) Pt(H2)|2H+||Cu2+|Cu (+) К
Катодом в этом случае является медный электрод. ЭДС гальванического элемента, измеренная при концентрации (активности) ионов меди 1 моль/л, равна 0,34 В и может быть выражена как ΔE=E(Cu2+/Cu)–E(2H+/H2). Так как E(2H+/H2) принят за нуль, то E(Cu2+/Cu)=ΔE=0,34В при стандартных условиях. Если медь заменить цинком, то катодом будет водородный электрод. Тогда E(Zn2+/Zn)= –ΔE= –0,76В.
Электродные потенциалы металлов, измеренные по отношению к водородному электроду при стандартных условиях, т.е. активной концентрации ионов металла в растворе, равной 1 моль/л, и температуре 25°С (298 К), называют стандартными и обозначают Е°. Так, Е°(Cu2+/Cu)=0,34В, Е°(Zn2+/Zn)= –0,76В. Ряд металлов, расположенных в порядке возрастания их стандартных электродных потенциалов, называетсярядом напряжений. В основных чертах он имеет следующий вид:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Ниже приведены основные следствия из ряда напряжений:
а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него.
б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют.
в) Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.
Величина электродного потенциала зависит от концентрации ионов металла в растворе его соли [Men+], их заряда (n) и температуры (Т), что выражается уравнением Нернста:
 ;
;
здесь F – число Фарадея (F=96485  96500 Кл/моль).
96500 Кл/моль).
При Т=298 К можно применять упрощенную форму уравнения Нернста:

Значения стандартных электродных потенциалов можно найти в справочнике *.
Величина ЭДС и изменение энергии Гиббса * для химического процесса, лежащего в основе работы гальванического элемента, связаны соотношением ΔG= –nFΔE, где n – количество электронов, передаваемых от восстановителя к окислителю. Необходимо иметь в виду, что реакцию необязательно проводить в гальваническом элементе. Она может быть проведена, например, в пробирке. Единственным отличием будет то, что полуреакции окисления и восстановления не разделены по электродам, а происходят в одной области пространства. Следовательно, ΔG может вычисляться точно так же, т.е. через ЭДС гипотетического гальванического элемента, найденную из электродных потенциалов полуреакций. В качестве примера рассмотрим реакцию:
2 Fe2+ + Cl2 → 2 Fe3+ + 2 Cl–
Здесь n=2, т.к. молекула хлора принимает два электрона (по одному от каждого иона Fe2+). Соотношение ΔG= –nFΔE находит применение для определения ΔG окислительно-восстановительных реакций * в растворах по измеренной величине ЭДС гальванических элементов, в которых они могут протекать, а также для выяснения возможности работы гальванического элемента на той или иной химической реакции, если для нее изменение энергии Гиббса ΔG известно.
Электролиз.
Электролиз - совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состояющую из двух электродов и расплава или растора электролита.
Пример электролиза - электролиз расплава хлорида магния.
Эта реакция не самопроизвольная, энергия постпуает от внешнего источника тока.
Катод - электрод, на котором происходит восстановление - катод;
электрод, на котором происходит окисление - анод. При электролизе катод заряжен отрицательно, анод - положительно, то есть распределение знаков заряда электродов противоположно гальваническому элементу. При электролизе химическая реакция осуществляется за счет энергии эл тока, подвидимой извне, в то время как при работе гальваническогоэлемента энергия самопроизвольно протекающей в ней химической реакции превращается в электрическую энергию.
Законы электролиза. Выход по току.
Количественные характеристики электролиза * выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде *, прямо пропорциональна количеству электричества, прошедшего через электролит *.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
 ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
Величина  называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8А·ч/моль.
называется электрохимическим эквивалентом вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8А·ч/моль.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы вещества, реально выделенного на электроде, к теоретической и умноженное на 100%, называют выходом по току:  .
.
Применение электролиза в технике
Электролиз находит широкое применение в технике.
Очистка или рафинирование металлов. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой "потенциалом разложения". При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900 °С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
Электролитическим путем получают тяжелую воду (D2O), в которой атомы водорода заменены атомами его изотопа — дейтерия (D) с атомной массой 2.
Потенциал разложения
Минимальный потенциал, при котором процесс электролиза становится возможным, называется потенциалом (напряжением) разложения или выделения. Его находят вычитанием электродного потенциала катиона из соответствующего значения электродного потенциала аниона. Например, потенциал разложения хлорида цинка равен E°(Cl2/2Cl–) – E°(Zn2+/Zn)=1,36–(–0,76)=2,12 В. Эта разность потенциалов, илиЭДС * внутреннего гальванического элемента *, возникающего в результате выделения на электродах * продуктов электролиза, имеет направление, противоположное внешней ЭДС, которая служит источником тока. Поэтому электролиз возможен при условии компенсации внутренней ЭДС внешним напряжением. Часто реально необходимый потенциал разложения электролита оказывается больше теоретической величины. Эта разность называется перенапряжением.
Коррозия - в тетради.

