Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высокихтемпературах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, чтореальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия  становится функцией не только температуры, но и объёма.
становится функцией не только температуры, но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием.
Уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь междудавлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
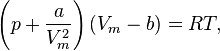
где
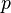 — давление,
— давление,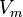 — молярный объём,
— молярный объём, — абсолютная температура,
— абсолютная температура,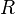 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка 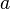 учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — объем молекул газа.
— объем молекул газа.
Для 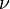 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:

где
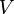 — объём,
— объём,
Вывод уравнения
Наиболее известны два способа получения уравнения: традиционный вывод самого Ван-дер-Ваальса и вывод методами статистической физики.
Традиционный вывод [править]
Рассмотрим сначала газ, в котором частицы не взаимодействуют друг с другом, такой газ удовлетворяет уравнению состояния идеального газа:

Далее предположим, что частицы данного газа являются упругими сферами одинакового радиуса r. Так как газ находится в сосуде конечного объёма, то пространство, где могут перемещаться частицы, будет несколько меньше. В исходной формуле следует вычесть из всего объёма некую его часть b, которая, вообще говоря, зависит только от вещества, из которого состоит газ. Таким образом, получается следующее уравнение:
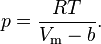
Стоит заметить, что вычитаемый объём b не будет в точности равен суммарному объёму всех частиц. Если частицы считать твёрдыми и абсолютно упругими шариками, то вычитаемый объём будет примерно в четыре раза больше. Это легко объясняется тем, что центры упругих шаров не могут приближаться на расстояние ближе  .
.
Далее Ван-дер-Ваальс рассматривает силы притяжения между частицами газа и делает следующие допущения:
- Частицы распределёнными равномерно по всему объёму.
- Силы притяжения стенок сосуда не учитываются, что в общем случае неверно.
- Частицы, находящиеся внутри сосуда и непосредственно у стенок, ощущают притяжение по-разному: внутри сосуда действующие силы притяжения других частиц компенсируют друг друга.
Таким образом, для частиц внутри сосуда силы притяжения не учитываются. А частицы, находящиеся непосредственно у края сосуда, затягиваются внутрь силой, пропорциональной концентрации:
 .
.
Число частиц, которые находятся непосредственно у стенок, в свою очередь тоже предполагается пропорциональным концентрации n. Можно считать, что давление на стенки сосуда меньше на некоторую величину, обратно пропорциональную квадрату объёма:

Окончательное уравнение:

Внутренняя энергия газа Ван-дер-Ваальса
Потенциальная энергия межмолекулярных сил взаимодействия вычисляется как работа, которую совершают эти силы, при разведении молекул на бесконечность:

Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моль газа:

где  — молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
— молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
Критические параметры
Критическими параметрами газа называются значения его макропараметров (давления, объёма и температуры) в критической точке, т.е. в таком состоянии, когда жидкая и газообразная фазы вещества неразличимы. Найдем эти параметры для газа Ван-дер-Ваальса, для чего преобразуем уравнение состояния:


Мы получили уравнение третьей степени относительно  .
.

В критической точке все три корня уравнения сливаются в один, поэтому предыдущее уравнение эквивалентно следующему:


Приравняв коэффициенты при соответствующих степенях  , получим равенства:
, получим равенства:



Из них вычислим значения критических параметров...



...и критического коэффициента:

Приведённые параметры
Приведённые параметры определяются как отношения

Если подставить в уравнение Ван-дер-Ваальса  получится приведённое уравнение состояния.
получится приведённое уравнение состояния.

Стоит отметить, что если вещества обладают двумя одинаковыми приведёнными параметрами из трёх, то и третьи приведённые параметры у них совпадают.
Недостатки уравнения Ван-дер-Ваальса
1. Для реальных веществ 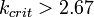
2. Для реальных веществ  (скорее,
(скорее,  )
)
3. Уравнение Ван-дер-Ваальса расходится с экспериментом в области двухфазных состояний.

