ИДЕА́ЛЬНЫЙ ГАЗ, теоретическая модель газа; в которой пренебрегают размерами частиц газа, не учитывают силы взаимодействия между частицами газа, предполагая, что средняя кинетическая энергия частиц много больше энергии их взаимодействия, и считают, что столкновения частиц газа между собой и со стенками сосуда абсолютно упругие.
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
- Диаметр молекулы
 пренебрежимо мал по сравнению со средним расстоянием между ними (
пренебрежимо мал по сравнению со средним расстоянием между ними ( ).
). - Импульс передается только при соударениях, то есть силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях.
- Суммарная энергия частиц газа постоянна, если отсутствует теплопередача и газ не совершает работы.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно полному импульсу, переданному при столкновении частиц со стенкой в единицу времени, внутренняя энергия — сумме энергий частиц газа.
По эквивалентной формулировке идеальный газ - такой газ, который одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака[8], то есть:

где 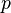 — давление,
— давление,  — абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
— абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
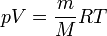 ,
,
где 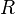 - универсальная газовая постоянная,
- универсальная газовая постоянная, 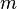 — масса,
— масса,  — молярная масса.
— молярная масса.
или

где 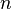 — концентрация частиц,
— концентрация частиц, 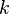 — постоянная Больцмана.
— постоянная Больцмана.
Для любого идеального газа справедливо соотношение Майера:

где  — универсальная газовая постоянная,
— универсальная газовая постоянная,  — молярная теплоемкость при постоянном давлении,
— молярная теплоемкость при постоянном давлении,  — молярная теплоемкость при постоянном объёме.
— молярная теплоемкость при постоянном объёме.

