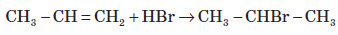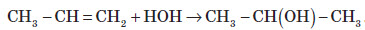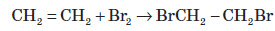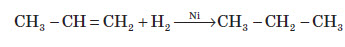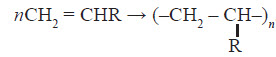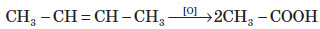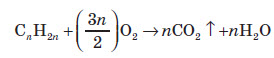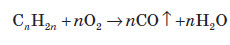Гомологічний ряд алкенів
Алкенами називають ненасичені вуглеводні, молекули яких містять один подвійний зв’язок. Перший представник цього класу етилен CH2 = CH2, у зв’язку із чим алкени також називають етиленовими вуглеводнями. Найближчі гомологи етилену:

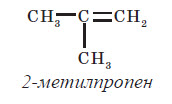
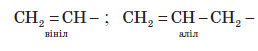
Ізомерія алкенів
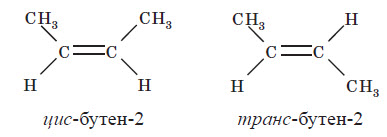
Структурна ізомерія алкенів обумовлена ізомерією карбонового ланцюга (наприклад, бутен-1 і 2-метилпропен) та ізомерією положення подвійного зв’язку (бутен-1 і бутен-2). Просторова ізомерія, або цис-транс-ізомерія, обумовлена різним положенням замісників щодо площини подвійного зв’язку. Якщо кожен з атомів Карбону при зв’язку C = C пов’язаний із двома різними замісниками, то ці замісники можуть розташовуватися з одного боку від площини подвійного зв’язку (цис-ізомер) або по обидва боки (транс-ізомер), наприклад:
Номенклатура алкенів
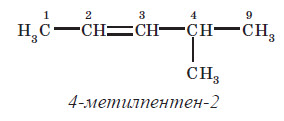
У алкенах з нерозгалуженим карбоновим ланцюгом нумерацію атомів Карбону починають із того кінця, до якого ближче перебуває подвійний зв’язок. У назві відповідного алкану закінчення -ан замінюється на -ен. У розгалужених алкенах головний ланцюг вибирають так, щоб він містив подвійний зв’язок, навіть якщо він при цьо му й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення подвійного зв’язку, наприклад:
Атоми Карбону при подвійному зв’язку перебувають у стані sp2-гібридизації. Три σ-зв’язки, утворені гібридними орбіталями, розташовуються в одній площині під кутом 120° один щодо одного. Утворений п-зв’язок при перекриванні негібридних p-орбіталей сусідніх атомів Карбону. При цьому атомні p-орбіталі перекриваються не в міжатомному просторі, а поза ним, тому таке «бічне» перекривання менш ефективне, і, отже, п-зв’язок є менш міцним, аніж σ-зв’язок. Додаткове п-зв’язування двох атомів вуглецю призводить до того, що зменшується відстань між ядрами, оскільки подвійний зв’язок є поєднанням σ- та п-зв’язків. Довжина подвійного зв’язку C = C становить 0,133 нм, що набагато менше від довжини одинарного зв’язку (0,154 нм).
Добування алкенів
1. Основним промисловим джерелом алкенів є крекінг алканів, які входять до складу нафти:
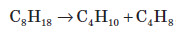
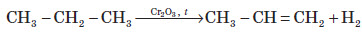
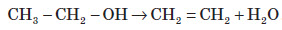
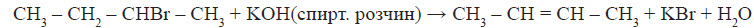
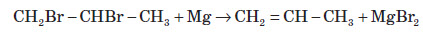
Хімічні властивості алкенів
Хімічні властивості алкенів визначаються наявністю в їхній молекулі подвійного зв’язку. При приєднанні полярних молекул типу HX (X: Hal, OH, CN) до несиметричних алкенів Гідроген переважно приєднується до більш гідрогенізованого атома Карбону, що примикає до подвійного зв’язку (правило Марковникова).