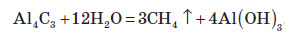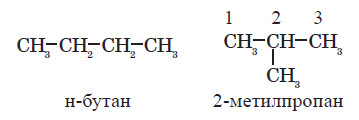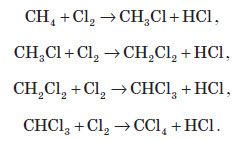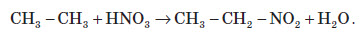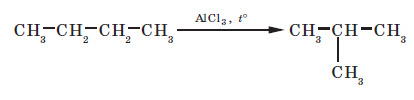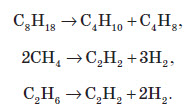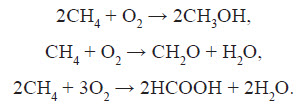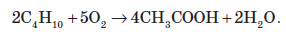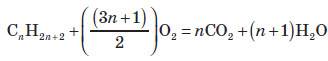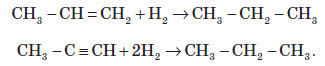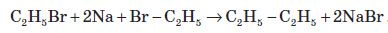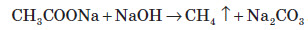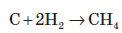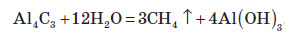Усі насичені вуглеводні можна вишикувати в ряд, в якому порядковий номер вуглеводню буде дорівнювати кількості атомів Карбону в молекулі. Такий гіпотетичний ряд називають гомологічним рядом, а сполуки, з яких складається цей ряд, називають гомологами.
Загальна формула: СnH2n+2.
Перші чотири члени гомологічного ряду алканів мають традиційні назви, інші назви походять від назв грецьких числівників з додаванням суфікса — ан.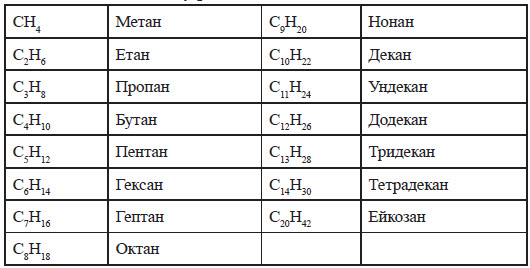
Для алканів здебільшого характерні структурні ізомери. Перші три члени гомологічного ряду алканів мають тільки по одному ізомеру. Тим часом бутан має вже два ізомерні вуглеводні:
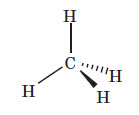
Кожен атом Карбону в алканах перебуває в стані sp3 -гібридизації й утворює чотири б-зв’язки C − C або C−H , кути між якими дорівнюють 109,5°. Завдяки такій орієнтації зв’язки від одного атома Карбону в алканах спрямовані до вершин тетраедра. Довжина зв’язку C − C в алканах дорівнює 0,154 нм, енергія зв’язку — 354 кДж / моль.
При нормальних умовах (0 °С, 1 атм) перші чотири гомологи являють собою гази; сполуки, що містять від 5 до 15 атомів Карбону — рідини; вищі вуглеводні — тверді речовини. При однаковому числі атомів Карбону молекули алканів з розгалуженою будовою мають більш низькі температури кипіння, ніж нормальні алкани.
Усі алкани являють собою безбарвні або білі речовини. Леткі вуглеводні мають характерний «бензиновий» запах. Вищі вуглеводні являють собою жирні на дотик м’які речовини, їхній типовий представник — парафін, з якого виготовляють свічі.
Алкани практично не розчинні у воді, тому що їхні молекули малополярні й не взаємодіють із молекулами води, вони добре розчиняються в неполярних органічних розчинниках, таких як тетрахлорметан тощо. Рідкі алкани легко змішуються один з одним.
Хімічні властивості алканів
За звичайних умов алкани хімічно інертні. Вони стійкі до дії багатьох реагентів: не взаємодіють із концентрованими сульфатною та нітратною кислотами, з концентрованими й розплавленими лугами, не окиснюються сильними окисниками — калій перманганатом KMnO4 тощо. Хімічна стійкість алканів пояснюється високою міцністю зв’язків C − C та C − H, а також їхньою неполярністю.
1. Галогенування. При взаємодії алканів з галогенами (хлором і бромом) під дією ультрафіолетового випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензаміщених алканів. Загальна схема цієї реакції показана на прикладі метану:
2. Нітрування (реакція Коновалова). Під час дії нітратної кислоти на алкани при температурі +140°С та невеликому тиску протікає радикальна реакція:
3. Ізомеризація. Нормальні алкани за певних умов можуть перетворюватися в алкани з розгалуженим ланцюгом:
4. Крекінг — це гомолітичний розрив зв’язків C − C, що протікає при нагріванні й під дією каталізаторів. При крекінгу алканів утворюються алкени й нижчі алкани, при крекінгу метану й етану утворюється ацетилен:
Ці реакції мають велике промислове значення. Таким шляхом висококиплячі фракції нафти (мазут) перетворюють у бензин, гас та інші цінні продукти.
5. Окиснення. При м’якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
М’яке каталітичне окиснення бутану киснем повітря — один із промислових способів добування оцтової кислоти:
На повітрі алкани згорають до CO2 та H2O :
Методи добування алканів
Основні природні джерела алканів — нафта й природний газ. Різні фракції нафти містять алкани від C5H12 до C30H62. Природний газ складається з метану (95 %) з домішкою етану та пропану.
Із синтетичних методів добування алканів можна виділити наступні:
1. Добування з ненасичених вуглеводнів. Взаємодія алкенів або алкінів з воднем («гідрування») відбувається в присутності металевих каталізаторів (Ni, Pd) при нагріванні:
2. Добування з галогенопохідних. При нагріванні моногалогенозаміщених алканів з металевим натрієм добувають алкани з подвійним числом атомів Карбону (реакція Вюрца):
3. Добування із солей карбонових кислот:
4. Добування метану. В електричній дузі, що горить в атмосфері водню, утворюється значна кількість метану:
Така сама реакція відбувається при нагріванні вуглецю в атмосфері водню при температурі +400—500 °С при підвищеному тиску в присутності каталізатора.
5. У лабораторних умовах метан часто добувають із алюміній карбіду: