Вычислить степень электролитической диссоциации и рН 0,1 М раствора азотистой кислоты (HNO2). Кд = 5 ⋅ 10-4.
Решение задачи
Степень электролитической диссоциации – это отношение числа распавшихся на ионы частиц к общему числу частиц. Степень диссоциации выражают в долях единицы или в процентах.
Запишем уравнение диссоциации азотистой кислоты (HNO2):
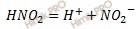
Так как азотистая кислота (HNO2) является слабым электролитом, то для расчета применяют упрощенную формулу закона разбавления Оствальда:
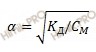
где:
α – степень электролитической диссоциации;
KД – константа диссоциации;
CM – молярная концентрация электролита.
Подставим данные задачи в уравнение Оствальда:
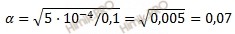
Найдем равновесную концентрацию ионов водорода:
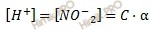
Получаем:
[H+] = 0,1 ∙ 0,07 = 0,007 (моль/л).
Вычислим pH раствора по формуле:
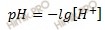
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
pH = – lg [7 ⋅ 10-3]
pH = 3 – lg 7
pH = 2,2
Ответ:
степень электролитической диссоциации 0,07;
pH раствора 2,2.

