Кислотность и основность – важнейшие понятия, определяющие многие фундаментальные физико-химические свойства и биологическую активность органических соединений.
Основные теории кислот и оснований:
· Ионная теория (С. Аррениус, 1887 г.)
· Протолитическая теория Бренстеда-Лоури (1923 г.).
· Апротонная теория Льюиса.
· Концепция жестких и мягких кислот и оснований (ЖМКО) Р. Пирсона (1963 г.).
Согласно ионной теории кислоты – это электролиты, отщепляющие в водном растворе ионы Н +, аоснования – электролиты, отщепляющие в водном растворе ионы ОН –. В результате ассоциации этих ионов между кислотой и основанием происходит реакция нейтрализации с образованием воды и соответствующей соли.
Кислоты –вещества, способные отдавать протон (доноры протона).
Основания – вещества, способные присоединять протон (акцепторы протона).
Количественная сравнительная оценка кислотности и основно-сти. Оценивается на основании уравнения кислотно-основного взаимо-действия, одним из компонентов которого является растворитель (вода или неводные растворители – ледяная CH3COOH, формамид, диметил-формамид, ДМСО и др.).
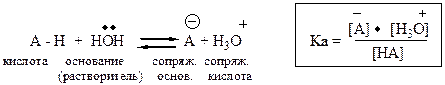
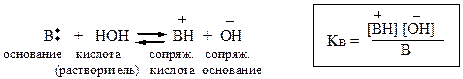
а – [ от англ. acid – кислота ]; в – [от англ. base – основание]
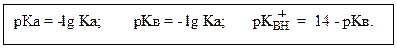
Качественная сравнительная оценка кислотности и основности органических соединений.Проводится с позиций статического и кинетического факторов.
Статический фактор, обуславливающий собственную кислотность или основность соединения в соответствии с его электронным строением в нереагирующем состоянии. Ка и Кв определяются в газовой фазе.
Кинетический фактор, обуславливающий кислотные и основные свойства в соответствии со стабильностью сопряженных оснований (анион) и кислот (катион), образующихся в результате кислотно-основного взаимодействия.
Сила кислоты определяется стабильностью сопряженного с ней основания (аниона). Чем стабильнее анион, тем сильнее кислота, а стабильность аниона зависит от степени делокализации электронной плотности (энтропийный фактор). Поэтому усиливают кислотность:
1) сопряжение с кислотным центром
2) большой радиус атома в кислотном центре
3) высокая электроотрицательность атома в кислотном центре
4) электроноакцепторные заместители в молекуле кислоты
Сравнительная сила кислот: карбоновые кислоты> фенолы > тиолы многоатомные спирты> одноатомные спирты > амины
1.Наиболее сильные кислоты (карбоновые кислоты, фенолы, тиолы) взаимодействуют со щелочами с образованием соли.

