Чему равен рН буферного раствора, образовавшегося при смешении 30 миллилитров 0,1 М раствора уксусной кислоты (СН3СООН) и 50 миллилитров 0,3 М раствора ацетата калия (СН3СООK)?
Kа = 1,74 ⋅ 10–5.
Решение задачи
Хотелось бы напомнить, что буферные растворы используют для того, чтобы поддерживать постоянную кислотность среды.
Обычно они содержат слабую кислоту и сопряженное ей основание (например, CH3COOH/CH3COO –) или слабое основание и сопряженную ему кислоту (например, NH3/NH4 +).
Буферные растворы образуются при неполной нейтрализации слабой кислоты сильным основанием или слабого основания сильной кислотой.
Рассчитаем объем буферного раствора (V) по формуле:
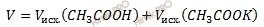
Получаем:
V = 30 + 50 = 80 (мл).
Вычислим молярную концентрацию уксусной кислоты (СН3СООН) и молярную концентрацию ацетата калия (СН3СООK) в буферной смеси, полученной путем смешения растворов уксусной кислоты (СН3СООН) и ацетата калия (СН3СООK):
СМ (СН3СООН) = (Vисх. (СН3СООН) ⋅ СМ,исх.(СН3СООН)) / V = (30 ⋅ 0,1) / 80 = 0,0375 (М),
СМ (СН3СООK) = (Vисх. (СН3СООK) ⋅ СМ,исх.(СН3СООK)) / V = (50 ⋅ 0,3) / 80 = 0,1875 (М).
Для нахождения рН буферного раствора, рассчитаем равновесную концентрацию ионов водорода по формуле:
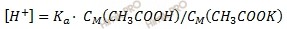
где Ka – константа диссоциации слабой кислоты.
Получаем:
[H+] = 1,74 ⋅ 10–5 ⋅ 0,0375 / 0,1875 = 3,48 ⋅ 10–6 (моль/л).
Вычислим рН буферного раствора по формуле:
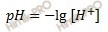
Получаем:
рН = –lg3,48 ⋅ 10–6 = 5,46
Ответ:
рН буферного раствора равен 5,46.

