Вычислить pH раствора, полученного смешением растворов 10 миллилитров 0,1 М раствора уксусной кислоты (СН3СООН) и 5 миллилитров 0,1 М раствора гидроксида натрия (NaOH). Kа = 1,75 ⋅ 10–5.
Решение задачи
Рассчитаем объем раствора (V) после смешения растворов по формуле:
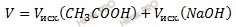
Получаем:
V = 10 + 5 = 15 (мл).
Вычислим концентрации компонентов после смешения растворов уксусной кислоты (СН3СООН) и гидроксида натрия (NaOH):
СМ (СН3СООН) = (Vисх. (СН3СООН) ⋅ СМ,исх.(СН3СООН)) / V = (10 ⋅ 0,1) / 15 = 0,066 (моль/л),
СМ (NaOH) = (Vисх. (NaOH) ⋅ СМ,исх.( NaOH)) / V = (5 ⋅ 0,1) / 15 = 0,033 (моль/л).
При смешении растворов протекает реакция:
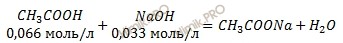
Найдем концентрацию ацетата натрия (CH3COONa):
СМ (СН3СООNa) = 0,066 – 0,033 = 0,033 (моль/л).
В результате протекания реакции получили буферный раствор. Рассмотрим равновесия в буферном растворе:
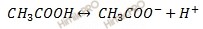
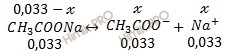
Константа диссоциации слабой кислоты рассчитывается по формуле:
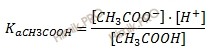
Найдем х:
1,75 ⋅ 10–5 = х ⋅ (0,033 + х) / 0,033 – х
Так как х << 0,033, то:
1,75 ⋅ 10–5 = х ⋅ 0,033 / 0,033 = х
Получаем:
[H+] = х = 1,74 ⋅ 10–5 (моль/л)
Вычислим рН раствора, полученного смешением растворов по формуле:
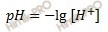
Получаем:
рН = -lg1,74 ⋅ 10–5 = 4,76
Ответ:
рН раствора после смешения растворов равен 4,76.

