
 Примеры
Примеры
Окислительно-восстановительная реакция между водородом и фтором

Разделяется на две полуреакции:
1) Окисление:

2) Восстановление:

Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:



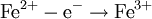

Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:




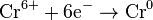
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.

