критерий направленности хим. реакций
изменение энтальпии и энтропии при хим. реакции

энтальпия энтропия
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При  процесс может протекать, при
процесс может протекать, при 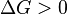 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 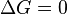 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства  (покинетическим причинам).
(покинетическим причинам).
ротекание любой химической реакции определяется двумя факторами. Первый фактор - энтальпийный (DН) - определяет изменение энергии системы. Второй фактор - энтропийный (TDS) - определяет изменение неупорядоченности системы. Таким образом протеканию химической реакции способствует уменьшение энергии системы и переход ее в более неупорядоченное состояние.
Для учета энтальпийного и энтропийного факторов в химической реакции, протекающей при постоянном давлении и температуре, в термодинамике была введена новая функция - изобарно-изотермический потенциал или энергия Гиббса (G). Энергия Гиббса связана с энтальпией и энтропией уравнением Гиббса:
DG = DH - TDS.
В любой закрытой системе при постоянном давлении и температуре возможен только такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса.
Вклад энтропийного и энтальпийного факторов значительно зависит от температуры.
При низких температурах T , Доминирующим становится энтальпийный фактор, поэтому при низких температурах, как правило, самопроизвольно протекают экзотермические реакции
При высоких температурах Доминирующим становится энтропийный фактор, поэтому при высоких температурах, как правило, самопроизвольно протекают реакции, ведущие к увеличению энтропии
В термодинамических расчетах широко используется понятие стандартной энергии Гиббса образования вещества. Стандартной энергией Гиббса образования сложного вещества называется изменение энергии Гиббса при образовании 1 моль данного соединения из простых веществ при стандартных условиях.
Стандартная энергия Гиббса образования простых веществ, находящихся в наиболее устойчивом в стандартных условиях фазовом состоянии, равна нулю.

