Второй закон определяет, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрациях могут протекать самопроизвольно,то есть без затраты работы извне; каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов
В отличие от первого закона термодинамики, второй закон обладает более ограниченной областью применения, он носит статистическийхарактер, то есть, применим к системам из большого числа частиц, поведение которых может быть выражено законами статики.
Чем больше тепла выделяется при экзотермических реакциях, тем большим сродством друг к другу обладают реагирующие вещества, тем прочнее связи в полученных продуктах. В обратном направлении процесс может пойти лишь при сообщении системе тепла извне.
Для любой термодинамической системы при данных условиях её существования всегда имеется некоторый общий критерий, которым характеризуется возможность, направление и предел самопроизвольного протекания процессов. Для изолированных систем критерием является энтропия (S).Термин был введен Рудольф Клаузиусом (1822-1888).
Любая система стремится к уменьшению величины ∆H и увеличению величины ∆S. Второй закон термодинамики устанавливает, чтов изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Энтропия- термодинамическая функция, которая характеризует меру упорядоченности системы или меру беспорядка.
Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру 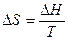
Отсюда следует, что в любых изолированных системах(а в них могут совершаться только адиабатные процессы) энтропия системы сохраняет постоянное значение. Следовательно, в изолированных системахвсякий самопроизвольно протекающий процесс сопровождается возрастанием энтропии. В случае закрытых систем энтропия в ходе процесса может, как увеличиваться, так и уменьшаться. Процессы для которых: 1) ∆S > 0 - расширение газов, фазовые превращения из твердого к жидкому и газообразному состоянию, растворение кристаллических веществ; 2) ∆S < 0 – сжатие газов, конденсация и кристаллизация веществ.
Энтропия зависит от всех видов движения частиц, содержащихся в молекуле, и возрастает при всех процессах, вызываемых движением частиц: испарение, плавление, растворение, диффузия, расширение газа; возрастает при ослаблении связей между атомами в молекулах и при разрыве связей, то есть при диссоциации молекул. Наоборот, при упрочнении связей энтропия уменьшается, то есть при кристаллизации, конденсации, сжижении газов.
Энтропия увеличивается с повышением температуры и уменьшается с повышением давления. В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул, а также по мере усложнения состава молеку

