-экзотермический процесс
-растворимость газов с повышением температуры уменьшается
-растворение газов в органич.жидкостях сопровождается поглощением тепла,следовательно с ростом температуры растворимость увеличивается
поглощение происходит изза того что энергия межмолекулярного притяжения между молекулами газа по модолю больше чем энегрия притяжения между молекулами газа и растворителя в растворе
растворение происходит за счет энтропии системы
газ=жидкость=насыщ. р-р газа в жидкости
обьем системы уменьшается,следовательно повышение давления приводит к смещению равновесия вправо, то есть к увеличению растворимости
Обычно растворение газов в жидкостях сопровождается уменьшением объема системы и выделением теплоты, близкой по величине к теплоте конденсации газа в жидкость. Водные растворы газов (Н2, СО, N2, O2, CH4) ведут себя как бесконечно разбавленные растворы, поскольку даже при очень высоких давлениях их растворимость мала. Закон Генри был установлен опытным путем именно при изучении растворимости газов в жидкостях: растворимость газов в жидкости прямо пропорциональна их парциальным давлениям:
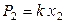 ,
, 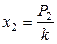 . (8.65)
. (8.65)
Сопоставление растворимости различных газов в одинаковых условиях с образованием реальных растворов не обнаруживает простых закономерностей. Однако можно отметить, что:
– полярные газы легче растворяются в полярных растворителях, чем в неполярных, и наоборот («подобное растворяется в подобном»);
– чем выше критическая температура неполярных газов, тем больше их растворимость в неполярных жидкостях;
–газы с большей температурой кипения обладают и большей растворимостью (при одинаковых давлениях); газы с низкими температурами кипения (He, H2, N2, Ne) мало растворимы в жидкостях;
– растворимость газа, химически взаимодействующего с растворителем (например, в водных растворах H2S, CO2, HCl, NH3), больше растворимости невзаимодействующих с растворителем газов (О2, N2);
– если в одном растворителе одновременно растворяются два газа, невзаимодействующие химически друг с другом и с растворителем, то они не оказывают влияние на растворимость друг друга.
При небольших давлениях растворимость газов в жидкостях обычно уменьшается с повышением температуры (константа Генри увеличивается с ростом температуры). При высоких давлениях растворимость газов в жидкости может и увеличиваться с ростом температуры (например, при растворении H2, He, Ne в органических растворителях или H2 в жидком аммиаке). В ряде случаев зависимость растворимости газа в жидкости от температуры проходит через минимум.
Количественно зависимость растворимости газа в жидкости от температуры можно описать уравнением:
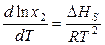 , (8.66)
, (8.66)
где DHS – изменение энтальпии при переходе 1 моль газа из газообразного состояния в состояние насыщенного жидкого раствора (последняя теплота растворения газа).
При низких температурах обычно DHS < 0 и растворимость газа x2 уменьшается с ростом температуры:
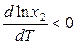 .
.
При высоких температурах DHS > 0 и растворимость газа x2 увеличивается с ростом температуры. Для температуры, при которой DHS = 0, растворимость данного газа в жидкости будет минимальной.
Растворимость газов в воде обычно уменьшается при добавлении других растворимых веществ, в частности, электролитов (так называемое «высаливание»). Влияние концентрации электролита в растворе на растворимость газов выражается следующим соотношением, предложенным Сеченовым:
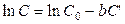 , (8.67)
, (8.67)
где С0 – растворимость данного газа в чистой воде при заданной температуре; С – растворимость газа при той же температуре в растворе электролита; C' – концентрация раствора электролита; b – эмпирическая постоянная, зависящая от природы газа и электролита и температуры.

