мера активности ионов водорода в растворе количественно выражающая его кислотность, равен модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выражен в молях на литр
Итак: рН + рОН = 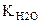 при t = 250C, рН + рОН =14.
при t = 250C, рН + рОН =14.
Величина рН (рОН) используется как мера кислотности, основности или нейтральности водных растворов.
рН< 7 – реакция среды кислая;
рН >7 – реакция среды щелочная;
рН = 7 – реакция среды нейтральная.
1. Водородный показатель
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов. При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
В пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Величина pH используется для характеристики кислотности раствора. Если концентрация ионов водорода равна [H+], то
pH = -lg [H+]
В чистой воде
[H+] = [OH-] = 10-7
В кислых растворах
[H+] > [OH-] и pH < 7
например, в 10-3 М растворе HCl pH = 3
В щелочных растворах
[H+] < [OH-] и pH > 7
например, в 10-2 М растворе NaOH
pOH = -lg2 • 10-2 = 2 - lg2 = 1,7
pH = 14 - pOH = 14 - 1,7 = 12,3
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования.
Таблица 1. Изменение цвета кислотно-основных индикаторов в зависимости от pH раствора.
|
Название |
Цвет индикатора в среде |
||
|
|
Кислая [H+] > [OH-] рН < 7 |
Нейтральная [H+] = [OH-] рН = 7 |
Щелочная [OH-] > [H+] рН > 7 |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Для более точного определения рН раствора используется рН - метр. pH-метр — прибор для измерения водородного показателя (показателя pH), характеризующего концентрацию ионов водорода в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных системах непрерывного контроля технологических процессов, в том числе в агрессивных средах. В частности, pH-метр применяется для аппаратного мониторинга pH растворов разделения урана и плутония, где требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.

