Вопрос 1 Гликолиз: химизм, энергетика, значение. Ферменты и регуляция гликолиза.
Вопрос 2 Уравнение Михаэлиса-Ментен.
Уравнение Михаэлиса — Ментен

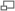
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описываетзависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента.Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
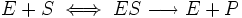
Уравнение имеет вид:
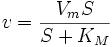 ,
,
где
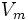 — максимальная скорость реакции, равная
— максимальная скорость реакции, равная 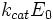 ;
;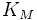 — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляетполовину от максимальной;
— константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляетполовину от максимальной;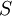 — концентрация субстрата.
— концентрация субстрата.
Вывод уравнения
Вывод уравнения был впервые предложен Бриггсом и Холдейном. Вывод уравнения скоростиферментативной реакции, описываемой схемой Михаэлиса-Ментен.
Обозначения констант скоростей:
k1 — константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата
k-1 — константа скорости реакции диссоциации фермент-субстратного комплекса на фермент и субстрат
k2 — константа скорости реакции превращения фермент-субстратного комплекса в фермент и продукт
Для фермент-субстратного комплекса применим метод квазистационарности, так как в подавляющембольшинстве реакций константа скорости превращения фермент-субстратного комплекса в фермент ипродукт много больше, чем константа скорости образования ферменто-субстратного комплекса изфермента и субстрата. Иными словами:
![\frac{d[ES]}{dt}=k_1[E][S]-(k_{-1}+k_2)[ES]=0](http://dic.academic.ru/pictures/wiki/files/48/02b5886d69e6deaba5cd43c5b0248e64.png)
Учтем тот факт, что фермент, изначально находившийся только в свободной форме, в процессе реакциинаходится как в виде фермент-субстратного комплекса, так и в виде молекул свободного фермента. Такимобразом:
[E]0 = [E] + [ES]
Преобразуем это к виду:
[E] = [E]0 − [ES]
И подставим в первое уравнение. После раскрытия скобок и группировки слагаемых получим следующее:
![\frac{d[ES]}{dt}=k_1[E]_0[S]-(k_1[S]+k_{-1}+k_2)[ES]=0](http://dic.academic.ru/pictures/wiki/files/48/03bcdc18008b4c1717c76ca5273fdd1e.png)
Выразим отсюда концентрацию фермент-субстратного комплекса:
![[ES]=\frac{k_1[E]_0[S]}{k_1[S]+k_{-1}+k_2}](http://dic.academic.ru/pictures/wiki/files/56/84ac85c4d84f17b6e345db349a7f94c0.png)
Скорость ферментативной реакции в целом (то есть скорость образования продукта) представляет собойскорость распада фермент-субстратного комплекса по реакции первого порядка с константой k2:
v = k2[ES]
Подставим в эту формулу выражение, которое мы получили для концентрации ES. Получим:
![v=\frac{k_1k_2[E]_0[S]}{k_1[S]+k_{-1}+k_2}](http://dic.academic.ru/pictures/wiki/files/97/a01829c7ce20f315f1be56ee18d1d078.png)
Разделим числитель и знаменатель на k1. В результате:
![v=\frac{k_2[E]_0[S]}{\frac{k_{-1}+k_2}{k_1}+[S]}](http://dic.academic.ru/pictures/wiki/files/50/25081437a58534023595c0d5813ae249.png)
Выражение в знаменателе — (k-1+k2)/k1 — называется константой Михаэлиса (Km). Это кинетическаяконстанта (с размерностью концентрации), которая равняется такой концентрации субстрата, при которойскорость ферментативной реакции составляет половину от максимального значения.
Для начальной стадии реакции можно пренебречь уменьшением концентрации субстрата. Тогдавыражение для начальной скорости реакции будет выглядеть так:
![v_0=\frac{k_2[E]_0[S]_0}{[S]_0+K_m}](http://dic.academic.ru/pictures/wiki/files/102/f66ebb2be2637d79f9569c65822ac22b.png)
Если k-1>k2, то на первой стадии ферментативной реакции с течением времени устанавливаетсяравновесие (квазиравновесный режим протекания реакции), и в выражение для скорости ферментативнойреакции входит уже не константа Михаэлиса, а субстратная константа KS, характеризующаявзаимодействие фермента с субстратом в равновесных условиях:
![v_0=\frac{v_{max}[S]}{[S]+K_s}](http://dic.academic.ru/pictures/wiki/files/51/33461c64f86b09f617f99020eb6e7f23.png) ;
; ![K_s=\frac{k_{-1}}{k_1}=\frac{[E][S]}{[ES]}](http://dic.academic.ru/pictures/wiki/files/48/0e643ccb56951ab88460fab4d9738049.png)
По значению KS можно судить о химическом сродстве субстрата к ферменту.

