Вопрос 1 Биосинтез белков. Процессы репликации, транскрипции и трансляции. Мутагенез и наследственные заболевания. Биотехнология и генная инженерия.
К биологическим мутагенам относят ДНК- и РНК-содержащие вирусы, некоторые полипептиды и белки, например О-стрептолизин и ряд ферментов рестриктаз, а также препараты некоторых ДНК и определенные плазмиды. Механизмы образования мутаций при действии различных биологических факторов не вполне ясны, однако агенты, содержащие нуклеиновые кислоты, могут вызывать нарушение процессов рекомбинации,
что приводит к возникновению мутаций. Действие рестриктаз сводится к «разрезанию» цепей ДНК в месте (локусе) определенной последовательности нуклеотидов, специфичном для каждой рестриктазы.
Для устранения первичных повреждений генетических структур, вызванных мутагенами, в клетке существует ряд систем восстановления, или репарации, генетических повреждений. В настоящее время таких систем насчитывается более десяти. Однако в ходе репарации часть первичных повреждений может остаться и привести к возникновению мутаций.
По характеру изменения генотипа различают генные (точечные, или точковые) мутации, хромосомные мутации и геномные мутации. Генные мутации представляют собой наследственные, микроскопически невыявляемые изменения в хромосомах. При использовании высокоразрешающих методов анализа хромосом у человека установлено, что природа ряда мутаций, ранее считавшихся генными. приводящих, например, к появлению ретинобластом, синдромов Лангера — Гидиона, Прадера — Вилли и др., состоит в делении (потере) участка хромосомы. Истинно генные мутации связаны либо с заменой пары азотистых оснований в полинуклеотидной цепи ДНК, что было впервые установлено для серповидно-клеточной анемии у человека, либо с вставкой или выпадением нескольких отдельных нуклеотидов, характерных для мутаций типа сдвига «рамки считывания».
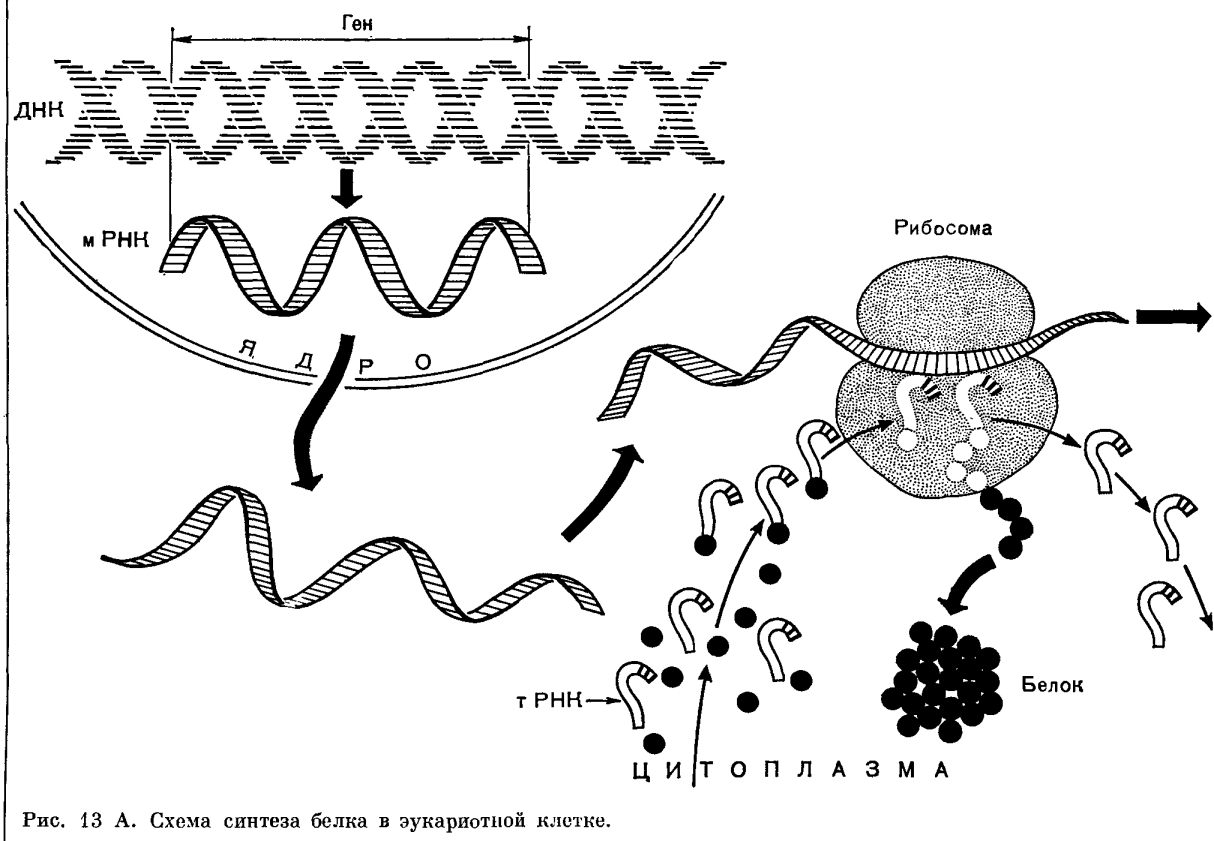
Все эти реакции - матричные, т. е. на одной матрице (молекуле ДНК или и-РНК) может синтезироваться бесконечное количество копий. Они основаны на принципе комплементарности - т. е. на соответствии друг другу пар нуклеотидов (репликация и транскрипция) или триплетов нуклеотидов и аминокислот (трансляция) . Все эти реакции - ферментативные.
РЕПЛИКАЦИЯ = удвоение ДНК. Это полуконсервативная матричная реакция. Материнская ДНК состоит из 2 комплементарных друг другу полинуклеотидных цепей; комплементарные нуклеотиды соединены друг с другом водородными связями, которые и связывают эти 2 цепи в двойную спираль. В процессе репликации эти водородные связи разрушаются, и на каждой из цепей синтезируется новая (дочерняя) полинуклеотидная цепь по принципу комплементарности: аденину комплементарен тимин, а гуанину - цитозин. Таким образом, в каждой новой молекуле ДНК одна цепь - материнская, а другая - дочерняя (в этом и заключается полуконсервативность синтеза) .
ТРАНСКРИПЦИЯ (от англ. transcript - переписывание) - синтез и-РНК на ДНК (каждая молекула и-РНК копирует 1 ген) . Принцип тот же, но адениловому нуклеотиду ДНК комплементарен не тимидиловый, а урациловый нуклеотид РНК. Синтез и-РНК обычно протекает только на одной из цепей ДНК.
Реплицация и транскрипция происходят в ядре клетки.
ТРАНСЛЯЦИЯ (от англ. translate - перевод) - синтез молекулы белка (полипептидной цепи) на молекуле и-РНК. Происходит в цитоплазме на рибосомах (на гранулярной ЭПС, в митохондриях, хлоропластах) . В рибосомах имеются 2 активных центра - аминоацильный и пептидильный, в которых осуществляется присоединение к полипептидной цепи новых аминокислот (реакция поликонденсации) в соответствии с генетическим кодом (каждому триплету нуклеотидов = кодону соответсвует определённая аминокислота; генетический код вырожден: многие аминокислоты кодируются не одним, а несколькими кодонами) . Аминокислоты к месту синтеза (рибосомам) транспортируются молекулами т-РНК, имеющими на средней петле антикодон, комплементарный кодонам и-РНК, кодирующим соответствующую аминокислоту. После присоединения аминокислоты, соответствующей находящемуся в активном центре рибосомы триплету и-РНК, рибосома делает "шаг", и в активном центре оказывается следующий триплет. На одной молекуле и-РНК одновременно идёт синтез нескольких полипептидных цепей на нескольких рибосомах (комлекс и-РНК и рибосом = полисома) .
Пластический обмен (ассимиляция или анаболизм) – совокупность реакций биологического синтеза. Название этого вида обмена отражает его сущность: из веществ, поступающих в клетку из вне, образуются вещества, подобные веществам клетки.
Рассмотрим одну из важнейших форм пластического обмена – биосинтез белков. Биосинтез белков осуществляется во всех клетках про -и эукариот. Информация о первичной структуре (порядке аминокислот) белковой молекулы закодирована последовательностью нуклеотидов в соответствующем участке молекулы ДНК — гене.
Ген— это участок молекулы ДНК, определяющий порядок аминокислот в молекуле белка. Следовательно, от порядка нуклеотидов в гене зависит порядок аминокислот в полипептиде, т.е. его первичная структура, от которой в свою очередь зависят все другие структуры, свойства и функции белковой молекулы.
Система записи генетической информации в ДНК (и - РНК) в виде определенной последовательности нуклеотидов называется генетическим кодом. Т.е. единица генетического кода (кодон) — это триплет нуклеотидов в ДНК или РНК, кодирующий одну аминокислоту.
Всего генетический код включает 64 кодона, из них 61 кодирующий и 3 некодирующих (кодоны-терминаторы, свидетельствующие об окончании процесса трансляции).
Кодоны-терминаторы в и - РНК: УАА, УАГ, УГА, в ДНК: АТТ, АТЦ, АЦТ.
Начало процесса трансляции определяет кодон-инициатор (АУГ, в ДНК — ТАЦ), кодирующий аминокислоту метионин. Этот кодон первым входит в рибосому. Впоследствии метионин, если он не предусмотрен в качестве первой аминокислоты данного белка, отщепляется.
Генетический код обладает характерными свойствами.
1. Универсальность — код одинаков для всех организмов. Один и тот же триплет (кодон) в любом организме кодирует одну и ту же аминокислоту.
2. Специфичность — каждый кодон шифрует только одну аминокислоту.
3. Вырожденность — большинство аминокислот могут кодироваться несколькими кодонами. Исключение составляют 2 аминокислоты — метионин и триптофан, имеющие лишь по одному варианту кодона.
4. Между генами имеются «знаки препинания» — три специальных триплета (УАА, УАГ, УГА), каждый из которых обозначает прекращение синтеза полипептидной цепи.
5. Внутри гена «знаков препинания» нет.
Для того, чтобы синтезировался белок, информация о последовательности нуклеотидов в его первичной структуре должна быть доставлена к рибосомам. Этот процесс включает два этапа – транскрипцию и трансляцию.
Транскрипция (переписывание) информации происходит путем синтеза на одной из цепей молекулы ДНК одноцепочной молекулы РНК, последовательность нуклеотидов которой точно соответствует последовательности нуклеотидов матрицы – полинуклеотидной цепи ДНК.
Она (и - РНК) является посредником, передающим информацию от ДНК к месту сборки молекул белка в рибосоме. Синтез и - РНК (транскрипция) происходит следующим образом. Фермент (РНК - полимераза) расщепляет двойную цепочку ДНК, и на одной из ее цепей (кодирующей) по принципу комплементарности выстраиваются нуклеотиды РНК. Синтезированная таким образом (матричный синтез) молекула и - РНК выходит в цитоплазму, и на один ее конец нанизываются малые субъединицы рибосом.
Второй этап в биосинтезе белка — трансляция — это перевод последовательности нуклеотидов в молекуле и - РНК в последовательность аминокислот в полипептиде. У прокариот, не имеющих оформленного ядра, рибосомы могут связываться с вновь синтезированной молекулой и - РНК сразу же после ее отделения от ДНК или даже до полного завершения ее синтеза. У эукариот и - РНК сначала должна быть доставлена через ядерную оболочку в цитоплазму. Перенос осуществляется специальными белками, которые образуют комплекс с молекулой и - РНК. Кроме функций переноса эти белки защищают и - РНК от повреждающего действия цитоплазматических ферментов.
В цитоплазме на один из концов и - РНК (а именно на тот, с которого начинается синтез молекулы в ядре) вступает рибосома и начинается синтез полипептида. По мере продвижения по молекуле РНК рибосома транслирует триплет за триплетом, последовательно присоединяя аминокислоты к растущему концу полипептидной цепи. Точное соответствие аминокислоты коду триплета и - РНК обеспечивается т - РНК.
Транспортные РНК (т - РНК) «приносят» аминокислоты в большую субъединицу рибосомы. Молекула т - РНК имеет сложную конфигурацию. На некоторых участках ее между комплементарными нуклеотидами образуются водородные связи, и молекула по форме напоминает лист клевера. На ее верхушке расположен триплет свободных нуклеотидов (антикодон), который соответствует определенной аминокислоте, а основание служит местом прикрепления этой аминокислоты (рис. 1).

Рис. 1. Схема строения транспортной РНК: 1 — водородные связи; 2 — антикодон; 3 —место прикрепления аминокислоты.
Каждая т - РНК может переносить только свою аминокислоту. Т-РНК активируется специальными ферментами, присоединяет свою аминокислоту и транспортирует ее в рибосому. Внутри рибосомы в каждый данный момент находится всего два кодона и-РНК. Если антикодон т-РНК является комплементарным кодону и-РНК, то происходит временное присоединение т-РНК с аминокислотой к и-РНК. Ко второму кодону присоединяется вторая т-РНК, несущая свою аминокислоту. Аминокислоты располагаются рядом в большой субъединице рибосомы, и с помощью ферментов между ними устанавливается пептидная связь. Одновременно разрушается связь между первой аминокислотой и ее т-РНК, и т-РНК уходит из рибосомы за следующей аминокислотой. Рибосома перемещается на один триплет, и процесс повторяется. Так постепенно наращивается молекула полипептида, в которой аминокислоты располагаются в строгом соответствии с порядком кодирующих их триплетов (матричный синтез) (рис. 2).

Рис. 2. Схема бисинтеза белка: 1 — и-РНК; 2 - субъединицы рибосомы; 3 — т-РНК с аминокислотами; 4 — т-РНК без аминокислот; 5 — полипептид; 6 — кодон и-РНК; 7- антикодон т-РНК.
Одна рибосома способна синтезировать полную полипептидную цепь. Однако, нередко по одной молекуле и-РНК движется несколько рибосом. Такие комплексы называются полирибосомами. После завершения синтеза полипептидная цепочка отделяется от матрицы – молекулы и-РНК, сворачивается в спираль и приобретает свойственную ей (вторичную, третичную или четвертичную) структуру. Рибосомы работают очень эффективно: в течение 1с бактериальная рибосома образует полипептидную цепь из 20 аминокислот.
6.1. Биотехнология
Биотехнология является наукой, которая на основе изучения процессов жизнедеятельности живых организмов, главным образом микроорганизмов, животных и растительных клеток, использует эти биологические процессы, а также сами биологические объекты для промышленного производства продуктов, необходимых для жизни человека или воспроизводства биоэффектов, не проявляющихся в естественных условиях (А.А. Воробьев).
6.1.1. Объекты биотехнологии, ее цели и задачи
Биотехнология (от греч. bios - жизнь, tecen - искусство, logos - наука) представляет собой область знаний, которая возникла и оформилась на стыке микробиологии, молекулярной биологии, генной инженерии, иммунологии, химической технологии и ряда других наук. Рождение биотехнологии обусловлено потребностями общества в новых, более дешевых продуктах для народного хозяйства, в том числе для медицины и ветеринарии, а также принципиально новых технологиях. Целью биотехнологии являются получение продуктов из биологических объектов или с их применением, а также воспроизводство биоэффектов, не встречающихся в природе. В качестве биологических объектов чаще всего используются одноклеточные микроорганизмы, животные и растительные клетки, а также организм животных, человека или растений. Выбор этих объектов обусловлен следующими причинами.
Клетки являются своего рода биофабриками, вырабатывающими в процессе жизнедеятельности разнообразные ценные продукты: белки, жиры, углеводы, витамины, аминокислоты, антибиотики, гормоны, антитела, антигены, ферменты, спирты и т.д. Многие
из этих продуктов, крайне необходимых в жизни человека, пока недоступны для получения небиотехнологическими способами.
Клетки чрезвычайно быстро воспроизводятся. Так, бактериальная клетка делится через каждые 20-60 мин, дрожжевая - через 1,5-2 ч, животная - через 24 ч, что позволяет за относительно короткое время искусственно нарастить на сравнительно дешевых и недефицитных питательных средах в промышленных масштабах огромные количества биомассы микробных, животных или растительных клеток.
Биосинтез сложных веществ, таких, как белки, антибиотики, антигены, антитела, значительно экономичнее и технологически доступнее, чем другие виды химического синтеза. При этом исходное сырье для биосинтеза, как правило, проще, дешевле и доступнее, чем сырье для других видов синтеза. Для этого используются отходы сельскохозяйственной, рыбной продукции, пищевой промышленности, растительное сырье, например рыбная мука, меласса, дрожжи, древесина и др.
Биотехнология использует следующие продукты одноклеточных:
• сами клетки как источник целевого продукта;
• крупные молекулы, которые синтезируются клетками в процессе выращивания, - ферменты, токсины, антигены, антитела, пептидогликаны и др.;
• первичные метаболиты - низкомолекулярные вещества (мол. масса менее 1500 Д), необходимые для роста клеток - аминокислоты, витамины, нуклеотиды, органические кислоты и др.;
• вторичные метаболиты (идиолиты) - низкомолекулярные и макромолекулярные соединения, не требующиеся для роста клеток, - антибиотики, алкалоиды, токсины, гормоны и др.
Биотехнология использует эту продукцию клеток как сырье, которое в результате технологической обработки превращается в конечный, пригодный для использования продукт.
Помимо микроорганизмов, животных и растительных клеток, биотехнология в качестве биологических объектов использует органы и ткани человека и животных, растения, организм животных и человека. Например, для получения инсулина используется поджелудочная железа крупного рогатого скота и свиней, гормона роста - гипофизы трупов человека, иммуноглобулинов - организм лошадей и других животных, препаратов крови - кровь доноров и т.д.
Биотехнология, используя перечисленные выше биологические объекты, получает огромный ассортимент продукции, применяемой в медицине, ветеринарии, сельском хозяйстве, пищевой и химической промышленности, других отраслях народного хозяйства. К ним относятся продукты, без которых немыслимо существование современного человека: антибиотики, витамины, ферменты, вакцины, гормоны, аминокислоты, нуклеотиды, комплемент и препараты крови, иммуномодуляторы, антитела, диагностические препараты, сердечно-сосудистые, противоопухолевые и множество других фармацевтических препаратов, пищевые и кормовые белки, биологические средства защиты растений, инсектициды, сахара, спирты, липиды, дрожжи, кислоты, бутанол, ацетон и др.
Помимо этого биотехнология играет большую роль в оздоровлении окружающей среды: с помощью биотехнологических процессов проводят очистку от загрязняющих веществ почвы, водоемов, воздушной среды путем их биоконверсии и биодеградации.
Однако биотехнология не ограничивается получением только вышеперечисленных продуктов. Значительные, более масштабные и революционные проблемы она решает на пути создания трансгенных животных и растений, т.е. создания новых, ранее неизвестных пород животных и растений, а также клонирования животных. Новейший раздел биотехнологии - генная и белковая инженерия - позволяет получать совершенно уникальные биотехнологические эффекты, открывать способы диагностики, профилактики и лечения врожденных болезней, влиять на свойства генома человека, животных и растений.
Вопрос 2 Ферменты и витамины.
Витами́ны (от лат. vita — «жизнь») — группа низкомолекулярных органических соединений относительно простого строения и разнообразной химической природы. Это сборная по химической природе группа органических веществ, объединённая по признаку абсолютной необходимости их для гетеротрофного организма в качестве составной части пищи. Автотрофные организмы также нуждаются в витаминах, получая их либо путём синтеза, либо из окружающей среды. Так, витамины входят в состав питательных сред для выращивания организмов фитопланктона[1]. Большинство витаминов являются коферментами или их предшественниками[2].
Витамины содержатся в пище (или в окружающей среде) в очень малых количествах, и поэтому относятся к микронутриентам. К витаминам не относят микроэлементыи незаменимые аминокислоты[2].
Наука на стыке биохимии, гигиены питания, фармакологии и некоторых других медико-биологических наук, изучающая структуру и механизмы действия витаминов, а также их применение в лечебных и профилактических целях, называется витаминологией.[3]
Витамины выполняют каталитическую функцию в составе активных центров разнообразных ферментов, а также могут участвовать в гуморальной регуляции в качестве экзогенных прогормонов и гормонов. Несмотря на исключительную важность витаминов в обмене веществ, они не являются ни источником энергии для организма (не обладают калорийностью), ни структурными компонентами тканей.
Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организме наступают характерные и опасные патологические изменения.
Большинство витаминов не синтезируются в организме человека, поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. Исключения составляютвитамин D, который образуется в коже человека под действием ультрафиолетового света; витамин A, который может синтезироваться из предшественников, поступающих в организм с пищей; и ниацин, предшественником которого являетсяаминокислота триптофан. Кроме того, витамины K и В3 обычно синтезируются в достаточных количествах бактериальной микрофлорой толстого кишечника человека[2].
С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: отсутствие витамина — авитаминоз, недостаток витамина —гиповитаминоз, и избыток витамина — гипервитаминоз.
На 2012 год 13 веществ (или групп веществ) признано витаминами. Ещё несколько веществ, например карнитин и инозитол, находятся на рассмотрении[4]. Исходя из растворимости, витамины делят на жирорастворимые — A, D, E, K, и водорастворимые — C и витамины группы B. Жирорастворимые витамины накапливаются в организме, причём их депо являются жировая ткань и печень. Водорастворимые витамины в существенных количествах не депонируются и при избытке выводятся с водой. Это объясняет бо́льшую распространённость гиповитаминозов водорастворимых витаминов и гипервитаминозов жирорастворимых витаминов.
Витамины условно обозначаются буквами латинского алфавита: A, B, C, D, E, H, K и т. д. Впоследствии выяснилось, что некоторые из них являются не самостоятельными веществами, а комплексом отдельных витаминов. Так, например, хорошо изучены витамины группы В. Названия витаминов по мере их изучения претерпевали изменения (данные об этом приводятся в таблице). Современные названия витаминов приняты в 1956 году Комиссией по номенклатуре биохимической секции Международного союза по чистой и прикладной химии.
Для некоторых витаминов установлено также определенное сходство физических свойств и физиологического действия на организм.
До настоящего времени классификация витаминов строилась, исходя из растворимости их в воде или жирах. Поэтому первую группу составляли водорастворимые витамины (C, P и вся группа B), а вторую — жирорастворимые витамины — липовитамины (A, D, E, K). Однако ещё в 1942—1943 годах академик А. В. Палладин синтезировал водорастворимый аналог витамина К — викасол. А за последнее время получены водорастворимые препараты и других витаминов этой группы. Таким образом, деление витаминов на водо- и жирорастворимые до некоторой степени теряет свое значение.
| Буквенное обозначение | Химическое название согласно международной номенклатуре
(другие названия — в скобках) |
Растворимость (Ж — жирорастворимый В — водорастворимый) |
Последствия гиповитаминоза, физиологическая роль | Верхний допустимый уровень | Суточная потребность |
|---|---|---|---|---|---|
| A1
|
Ретинол (аксерофтол, противоксерофтальмический витамин) Дегидроретинол |
Ж[8] | Куриная слепота, ксерофтальмия | 3000 мкг[8] | 900 (взрослые), 400—1000 (дети) мкг рет. экв.[8] |
| B1 | Тиамин (аневрин, антиневритный) | В | Бери-бери | не установлен[8] | 1,5 мг[8] |
| B2 | Рибофлавин | В | Арибофлавиноз | не установлен[8] | 1,8 мг[8] |
| B3 , PP | никотинамид (никотиновая кислота, ниацинамид, противопеллагрический витамин) | В | Пеллагра | 60 мг[8] | 20 мг[8] |
| B4 | Холин | В | Расстройства печени | 20 г | 425—550 мг |
Ферменты. Общие сведения о белковых катализаторах биохимических реакций. Биомедицинское значение ферментов. Классификация ферментов и номенклатура Ферменты в клинической диагностике.
Ферменты – это вещества, без которых невозможно течение множества процессов в организме. На самом деле, ферменты принимают участие не только в переваривании пищи, но и в работе центральной нервной системы, в процессах роста новых клеток. Ферменты относятся к белкам. Но в их составе есть и минеральные соли. Ферментов достаточно много и каждый обладает совершенно уникальным действием на узкий круг веществ. Ферменты не могут заменять друг друга. Ферменты могут действовать только при температуре, не превышающей пятидесяти четырех градусов. Но и слишком низкие температуры тоже не способствуют их активности. Ведь «работают» ферменты в человеческом теле и оптимальна для них именно температура тела. Губителен для ферментов солнечный свет и кислород. Метаболизм жиров, белков, минералов и углеводов проходит только в присутствии ферментов. Ферменты действуют в кишечнике. При этом витамин Е помогает ферментам достичь в неизменном состоянии кишечника. Работа ферментов значительно сокращает энергетические затраты организма на переработку пищи. Если Вы не любитель сырых фруктов и овощей, то, скорее всего, у Вас в организме ферментов вырабатывается недостаточно. Все ферменты разделяются на три основных группы: амилаза, липаза и протеаза. Фермент амилаза необходим для переработки углеводов. Под воздействием амилазы углеводы разрушаются и легко всасываются в кровь. Амилаза присутствует как в слюне, так и в кишечнике. Амилаза тоже бывает разной. Для каждого вида сахаров существует собственный вид этого фермента. Липаза – это ферменты, которые присутствуют в желудочном соке и вырабатываются поджелудочной железой. Липаза необходима для усвоения организмом жиров. Протеаза – это группа ферментов, которые присутствуют в желудочном соке и тоже вырабатываются поджелудочной железой. Кроме этого, протеаза присутствует и в кишечнике. Протеаза необходима для расщепления белков. Существуют такие ферменты, которые запускают процессы обмена веществ внутри клеток. Практически нет в организме такой системы, которая не вырабатывала бы свои ферменты. Существуют и продукты питания, в которых есть собственные ферменты. Это авокадо, ананасы, папайя, манго, бананы и различные пророщенные зерна. В организме вырабатываются и так называемые протеолитические ферменты, которые не только участвуют в пищеварении, но еще и снимают воспалительные процессы. К таким ферментам относят панкреатин, пепсин, ренин, трипсин и химотрипсин. Наиболее распространенным в лекарственной форме является фермент панкреатин. Его применяют в случае нехватки ферментов в организме, для облегчения переваривания пищи, при аллергиях на еду, различных тяжелых нарушениях иммунитета, а также других сложных внутренних болезнях. Если Вы страдаете ферментной недостаточностью, то предпочтительнее использовать такие лекарства, которые содержат сразу несколько ферментов. Но есть препараты, содержащие только один какой-либо фермент. Обычно ферментные препараты нужно употреблять во время еды, но иногда эффективнее прием после еды. Лекарственные средства, которые содержат ферменты, следует держать в холодильнике. Ферментные препараты смело можно назвать БАД (биологически активными добавками). Но применять их бесконтрольно на протяжении длительного времени все же не стоит. Лучше проконсультироваться с врачом.
Первоначально ферментам давали названия, образуемые путем добавления окончания  к названию субстрата, на который данный фермент действует. Так, ферменты, гидролизующие крахмал (амилон), были названы амилазами; ферменты, гидролизующие жиры (
к названию субстрата, на который данный фермент действует. Так, ферменты, гидролизующие крахмал (амилон), были названы амилазами; ферменты, гидролизующие жиры ( -липазами; ферменты, гидролизующие белки (протеины), — протеиназами. Позднее ферментам, катализирующим сходные по типу реакции, стали давать название, указывающее тип соответствующей реакции — дегидрогеназы, оксидазы. декарбоксилазы, ацилазы и т.д. Многие из этих названий используются и теперь.
-липазами; ферменты, гидролизующие белки (протеины), — протеиназами. Позднее ферментам, катализирующим сходные по типу реакции, стали давать название, указывающее тип соответствующей реакции — дегидрогеназы, оксидазы. декарбоксилазы, ацилазы и т.д. Многие из этих названий используются и теперь.
Номенклатура, введенная Международным биохимическим союзом (IUB), на первый взгляд кажется сложной и громоздкой, но зато она является однозначной. Главный ее принцип состоит в том, что ферменты называют и классифицируют в соответствии с типом катализируемой химической реакции и ее механизмом; это существенно облегчает систематизацию данных, относящихся к различным аспектам метаболизма. Основные черты системы, введенной IUB, состоят в следующем.
1. Реакции и ферменты, которые их катализируют, подразделяются на шесть классов, в каждом из которых имеется несколько подклассов (от четырех до 13).
2. Название фермента состоит из двух частей: первая часть — название субстрата (или субстратов); вторая указывает тип катализируемой реакции и оканчивается на - аза.
3. Дополнительная информация, если она необходима для уточнения, заключается в скобки. Например, фермент, катализирующий реакцию  имеет номер 1.1.1.37 и называется L-малат: NADf оксидоредуктаза (декарбоксилирующая).
имеет номер 1.1.1.37 и называется L-малат: NADf оксидоредуктаза (декарбоксилирующая).
4. Каждый фермент имеет кодовый номер по классификации ферментов (КФ): первая цифра характеризует класс реакции, вторая — подкласс и третья — подподкласс. Четвертая цифра указывает порядковый номер фермента в его подподклассе. Таким образом, КФ 2.7.1.1 означает, что фермент относится к классу 2 (трансфераза), подклассу 7 (перенос фосфата) и подподклассу 1 (акцептором фосфата является спирт). Последняя цифра обозначает фермент гексокиназу, или АТР:  -гексозо-б-фосфотрансферазу, т. е. фермент, катализирующий
-гексозо-б-фосфотрансферазу, т. е. фермент, катализирующий
перенос фосфата с АТР на гидроксильную группу атома углерода в шестом положении глюкозы.
Ниже представлены все шесть классов ферментов и некоторые конкретные примеры. В скобках указано рекомендуемое название.
1. Оксидоредуктазы.Ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов, S и S:

Катализируют реакции, в которых участвуют такие группы, как  Некоторые подклассы:
Некоторые подклассы:
1.1. Ферменты, действующие на группу СН— ОН (донор электронов). Например:

1.4. Ферменты, действующие на группу Н-NH, (донор электронов). Например:
1.4.1.3. L-Глутамат: NAD(P)+ оксидоредуктаза (дезаминирующая) [глутаматдегидрогеназа из печени животных]. Запись  означает, что акцептором электронов может служить либо
означает, что акцептором электронов может служить либо  либо
либо  лутамат
лутамат 

2. Трансферазы. Ферменты, катализирующие перенос группы G (отличной от атома водорода) с субстрата S на субстрат 

Катализируют перенос одноуглеродных групп, альдегидных или кетонных остатков, а также ацильных, алкильных, гликозильных групп и групп, содержащих фосфор и серу. Некоторые подклассы:
2.3. Ацилтрансферазы. Например:
2.3.1.6. Ацетил-СоА:холин О-ацетилтрансфераза [холин-ацетилтрансфераза]

2.7. Ферменты, катализирующие перенос группы, содержащей фосфор. Например:
2.7.1.1. АТР:  -гексоза
-гексоза  -фосфотрансфераза [гек-сокиназа]
-фосфотрансфераза [гек-сокиназа]

3. Гидролазы. Ферменты, катализирующие гидролиз эфирных, сложноэфирных, пептидных и гликозильных связей, кислотных ангидридов, связей С— С, С-галоида и  Например:
Например:
3.1. Ферменты, действующие на сложноэфирные связи. Например:
3.1.1.8. Ацилхолин—ацилгидролаза [псевдохо-линэстераза]

3.2. Ферменты, действующие на гликозильные соединения. Например:

3.4. Ферменты, действующие на пептидные связи.
Классификация (с подразделением на 11 подклассов) учитывает различия между пептидазами и протеазами, выделяет ферменты, гидролизующие дипептиды или более крупные пептиды, отщепляющие одну или большее число аминокислот, атакующие связь на С-или  -конце. Протеиназы в соответствии с механизмом катализа подразделяются на сериновые, тиоловые и металлозависимые. Например:
-конце. Протеиназы в соответствии с механизмом катализа подразделяются на сериновые, тиоловые и металлозависимые. Например:
3.4.2.1. Сериновые протеиназы. Например: химотрипсин, трипсин, плазмин, факторы свертывания крови 
Карбоксильные (кислые) протеиназы. Например: пепсины А, В и С.
4. Лиазы. Ферменты, отщепляющие группы от субстратов по негидролитическому механизму, с образованием двойных связей.

Ферменты, действующие на связи  и С—галоид. Некоторые подгруппы:
и С—галоид. Некоторые подгруппы:
4.1.2. Альдегид-лиазы. Например:
4.1.2.7. Кетозо-1-фосфат-альдолаза [альдолаза]

4.2. Углерод—кислород лиазы. Например:

5. Изомеразы. В этот класс включены все ферменты, катализирующие взаимопревращения оптических, геометрических и позиционных изомеров. Некоторые подклассы:
5.2. Цис-гпранс-изотлерязы. Например:
5.2.1.3. все-трянс-Ретиналь 11 -цис-транс-изоме-раза [ретинальизомераза]

5.3. Ферменты, катализирующие взаимопревращение альдоз и кетоз. Например:
5.3.1.1.  лицеральдегид-3-фосфаткетол-изо-мераза [триозофосфатизомераза]
лицеральдегид-3-фосфаткетол-изо-мераза [триозофосфатизомераза]

6. Лигазы. (от лат. лигаре — связывать). Ферменты, катализирующие соединение двух молекул, сопряженное с разрывом пирофосфатной связи АТР или подобного соединения. В этот класс включены ферменты, катализирующие реакции, в ходе которых образуются связи  . Некоторые подклассы:
. Некоторые подклассы:
6.3. Ферменты, катализирующие образование связей  Например:
Например:
6.3.1.2. L-Глутамат:аммиак лигаза (ADP) [глу-таминсинтетаза]

6.4. Ферменты, катализирующие образование связей  Например:
Например:
6.4.1.2. Ацетил-СоА:  лигаза (ADP) [ацетил-Со А—карбоксилаза]
лигаза (ADP) [ацетил-Со А—карбоксилаза]