Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:

Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшениемэнтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж).
В химических процессах одновременно действуют два противоположных фактора — энтропийный ( ) и энтальпийный (
) и энтальпийный ( ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса ( ):
):

Из этого выражения следует, что  , то есть некоторое количество теплоты расходуется на увеличение энтропии (
, то есть некоторое количество теплоты расходуется на увеличение энтропии ( ), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты (
), эта часть энергии потеряна для совершения полезной работы (рассеивается в окружающую среду в виде тепла), её часто называют связанной энергией. Другая часть теплоты ( ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При  процесс может протекать, при
процесс может протекать, при 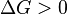 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 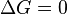 , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
Абсолютно достоверной характеристикой возможности протекания реакции при произвольных начальных условиях служит истинное изменение энергии Гиббса ΔG, связанное со стандартным изменением ΔG0.
Поэтому, в общем случае знак ΔG может не совпадать со знаком ΔG0, которая является лишь приближенным критерием возможности протекания реакции.
Положительные значения ΔG0 указывают, не на невозможность реакции, а лишь на незначительный или очень малый выход продуктов при стандартных условиях. Наличие второго слагаемого в правой части уравнения изотермы свидетельствует о том, что значительного выхода продуктов можно достигнуть даже при положительных значениях ΔG0 за счет создания в системе определенного соотношения между давлениями участников реакции.
Итак, следует проводить четкое различие между стандартным изменением энергии Гиббса реакции ΔG0 и ее истинным значение ΔG, отвечающим конкретным давлениям участников реакции.
Анализ уравнения изотермы химической реакции показывает, что знак ΔG0 будет совпадать со знаком ΔG в двух случаях:
1) парциальные давления участников реакции мало отличаются от стандартного значения (101325 Па);
2) ΔG0 велико по абсолютному значению ( > 40 кДж).

